амиды металлов
АМИДЫ МЕТАЛЛОВ
соед. общей формулы M(NH2)n, где п — степень окисления металла М. Лучше других изучены амиды (А.) щелочных металлов — устойчивые при нормальных условиях кристаллы (см. табл.). Практич. значение имеет амид натрия, который получают взаимод. расплавленного Na с газообразным NH3 или твердого Na с жидким NH3 при −30 °C в присутствии дисперсного железа. Применяют его для получения NaCN, NaN3, в производстве индиго, синтезе аминопиридинов.
СВОЙСТВА АМИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
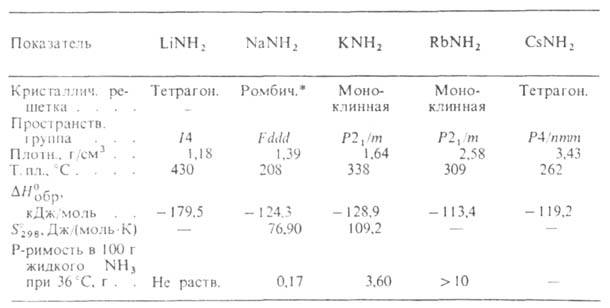
* Параметры решетки: а = 0,8964 нм, b = 1,0456 нм, с=0,8073 нм: число формульных единиц в ячейке z = 16.
А. металлов II группы также устойчивы. Свойства их исследованы мало. ЗначенияΔH0обр для амидов Ca, Ba, Zn и Cd равны соотв. -382,4, -318,0, — 157,3 и −54,0 кДж/моль. А. переходных металлов образуются при аммонолизе солей этих металлов и существуют только в жидком NH3. Удаление NH3 приводит к разложению этих А.
А. быстро гидролизуются водой с образованием МОН и NH3. Нагревание приводит к выделению NH3 и переходу А. в имиды или нитриды; А. ряда металлов могут разлагаться при нагр. с выделением N2 и H2 и образованием своб. металлов или их гидридов. Разложение А. с выделением N2 и NH3 происходит также под действием некоторых окислителей, напр. KMnO4. Углерод при нагр. восстанавливает А. до цианидов.
В жидком NH3 А. проявляют свойства, характерные для оснований в водных растворах. Их взаимод. с солями аммония NH4X приводит к образованию соли металла MX и своб. NH3, причем переходные металлы координируют NH3 и образуют аммиакаты.
А. щелочных металлов, Ca, Sr, Ba, Zn и Cd получают растворением соответствующего металла, его гидрида или металлоорг. соед. в жидком NH3 в присутствии катализаторов-переходных металлов или их солей. А. других металлов м. б. приготовлены также путем обменной реакции KNK2 с солями этих металлов в среде жидкого NH3. Многие А. переходных металлов образуются при аммонолизе солей этих металлов жидким NH3.
А. — восстановители в орг. синтезе.
Лит.: Jones К., The chemistry of nitrogen, Oxf., 1975; Nicholls D., Inorganic chemistry in liquid ammonia, Amst.-[a. o.], 1979.
П. М. Чукурев
