аммония перхлорат
АММОНИЯ ПЕРХЛОРАТ NH4C1O4
бесцветные кристаллы; ниже 238 °C устойчива ромбич. модификация (а = 0,9225 нм, в = 0,5815 нм, с = 0,7456 нм, z = 4, пространственная группа Pшш); плотн. 1,952 г/см3; C0p 128,1 Дж/(моль∙К); Δ H0обр- 295,2 кДж/моль; выше 238 °C устойчива кубич. форма (а = 0,763 нм, пространственная группа Fm3m), плотн. 1,732 г/см3 при 270 °C; ΔH0 полиморфного перехода 9 кДж/моль. С повьпиением давления температура перехода растет, достигая 300 °C при 0,4 ГПа. Растворимость А.п. при 25 °C (г в 100 г растворителя): в воде — 24,92; метаноле — 6,85; этаноле — 1,90; ацетоне — 2,26. А. п. раств. в расплаве LiClO4, эвтектика NH4ClO4 — LiClO4 имеет т. пл. 182 °C и содержит 32,6% А. п.
Выше 150 °C А. п. заметно разлагается (см. уравнения ниже), выше 250 °C он также возгоняется с диссоциацией на NH3 и HClO4 (при 270 °C давление диссоциации ~ 13 Па). В интервале 150–300 °C изотермич. разложение А. п. идет автокаталитически и практически прекращается после распада ок. 30% вещества. Остаток по составу и свойствам практически не отличается от исходного А. п., но имеет цеолитоподобную структуру. Способность вновь подвергаться такому распаду возвращается к остатку после обработки его парами веществ, растворяющих А. п., или после перекристаллизации. Распад А. п. выше 300 °C идет до конца и не автокаталитически. Кубич. модификация немного стабильнее ромбической, поэтому в области температур фазового перехода (235–250 °C) скорость распада уменьшается с ростом температуры. Обработка А. п. парами HClO4 ускоряет разложение, парами NH3-замедляет. Состав продуктов распада приближенно м. б. выражен уравнениями:
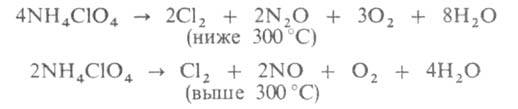
В промышленности А. п. получают обменной реакцией NaClO4 с NH4C1, (NH4)2SO4 или (NH4)2CO3, а также взаимод. водных растворов HClO4 с NH3. Применяют А. п. как окислитель твердых ракетных топлив и смесевых ВВ.
А. п. взрывоопасен, чувствителен к удару, трению, огню. Объем производства в США 50 тыс. т/год (1969).
Лит.: Механизм, кинетика и катализ термического разложения и горения перхлората аммония, пер. с англ., Новосиб., 1970.
