антимониды
АНТИМОНИДЫ (стибниды)
соед. сурьмы с металлами. Кристаллич. вещества с металлич. блеском, обычно серебристо-белого или серого цвета, с относительно высокими температурами плавления. Обладают металлич. или полупроводниковой проводимостью; некоторые А. при низких температурах-сверхпроводники. Щелочные металлы образуют А. состава M3Sb, MSb и, начиная с К, MSb2 и др. Число образуемых А. увеличивается от Li к Cs. Для соед. M3Sb характерна гексаген. Кристаллич. решетка типа Na3As, для MSb-моноклинная типа LiAs, для MSb2-моноклинная типа MgCu2. А. щелочных металлов — полупроводники с шириной запрещенной зоны 1,0–1,5 эВ. Медь и серебро образуют по неск. бер-толлидных фаз; для Cu известен также Cu2Sb. Получены только высшие антимониды Au-AuSb2 и AuSb3.
Для элементов II группы характерно образование M3Sb2. Для Be и Mg известны А. только такого состава; другие щел.-зем. металлы дают ряд А., в т. ч. MSb и MSb3, причем число соед. увеличивается от Ca к Ва. Цинк и кадмий образуют А. составов M3Sb2, MSb и M3Sb4, ртуть-Hg3Sb2.
Металлы подгруппы Ilia образуют А. состава MSb, имеющие наиб. практич. значение. Все они, кроме металло-подобного TISb, кристаллизуются в кубич. решетке типа сфалерита и являются полупроводниками. С ростом атомного номера металла увеличиваются межатомные расстояния в молекулах, понижаются температуры плавления, ширина запрещенной зоны и энергия диссоциации, уменьшается твердость и повышается плотность соединений. Элементы подгруппы III6, включая лантаноиды и актиноиды, образуют ряд А., из которых наиб. характерны: MSb (со структурой типа NaCl), M2Sb (с тетрагон, кристаллической решеткой), M4Sb3, MSb2 (с моноклинной или тетрагон, решеткой), M5Sb3 (с гексагон. решеткой типа Mn5Si3).
Из элементов подгруппы IVa только для Sn известен SnSb (с кубич. кристаллической решеткой). Переходные металлы IV-VIII групп образуют разнообразные А., из которых чаще других встречаются MSb, MSb2, MSb3, M2Sb, M3Sb. Число соед. при переходе от IV группы к VI уменьшается, а далее, начиная с подгруппы Со, снова увеличивается. При переходе от четвертого к шестому периоду наблюдается тенденция к уменьшению числа А. наиб. число А. у Ni (6), V и Rh (по 5). Для Cr, Mn, Fe, Ru известно по два А., для Mo, W и Os — по одному (Mo3Sb7, WSb и OsSb2). Большинство соед. состава MSb имеет гексагон. кристаллич. решетку типа NiAs или ромбическую типа МпР. Для MSb2 характерна структура типа пирита или марказита. Соед. M2Sb кристаллизуются обычно в тетрагон. решетке типа Cu2Sb. Элементы подгруппы Со образуют А. состава MSb3 с кубич. кристаллической решеткой типа CoAs3, элементы подгруппы Ti и V — соед. M3Sb с кубич. решеткой типа или Cr3Si.
или Cr3Si.
Большинство А. переходных элементов металлоподобны, некоторые соед. MSb2 и особенно MSb3 — полупроводники, причем с увеличением атомной массы металла в пределах группы ширина запрещенной зоны возрастает. Некоторые А. при низких температурах становятся сверхпроводниками, наиб. высокие температуры перехода у Nb5Sb4 (8,60 К), Ti3Sb (5,80 К). Некоторые А. — антиферромагнетики с относительно высокими точками Нееля: 723 К для CrSb, 213 К для USb. Другие, напр. MnSb, MnSb2, — ферромагнетики, для которых характерны анизотропия магн. свойств и изменение с температурой направления наиб. магн. восприимчивости.
Известен ряд двойных А., напр.: LiCdSb, K2CuSb2, BaZn2Sb2, TiSnSb, ZnSnSb2, NbSnSb. По свойствам близки к А. антимонохалькогениды MSbX, где X = S, Se, Те. Эти соед. металлоподобны или полупроводники, при низких температурах некоторые из них становятся сверхпроводниками.
А. щелочных и в неск. меньшей степени щел.-зем. металлов химически очень активны, легко окисляются, гидролизуются водой с выделением SbH3. Антимониды Mg и А1 менее активны, но легко разлагаются разб. кислотами. Все остальные А. взаимод. только с конц. кислотами или царской водкой. С увеличением содержания Sb в А. их хим. устойчивость повышается. Некоторые А., в частности образуемые щелочными металлами, раств. в солевых расплавах, напр. в смесях LiCl-LiF или NaCl-Nal.
Известно ок. 15 сравнительно редких минералов, относящихся к А., напр. дискразит Ag3Sb, брейтгауптит NiSb, уль-манит NiSbS.
А. синтезируют гл. обр. сплавлением компонентов в вакууме или в инертной атмосфере, иногда под слоем флюса (напр., из NaCl, KC1, CaCl2, BaCl2). Мелкие кристаллы и пленки получают из газовой фазы — сублимацией компонентов или путем хим. транспортных реакций. Монокристаллы выращивают методами направленной кристаллизации, вытягивания из расплава, горизонтальной зонной плавки. Эпитаксиальные пленки получают вакуумным напылением, осаждением из жидкой и газовой фаз. Некоторые А. (напр., SnSb, Cu2Sb) образуются в сплавах (баббитах, сурьмяных бронзах и др.). Осн. область применения А. — полупроводниковая техника.
СВОЙСТВА АНТИМОНИДОВ
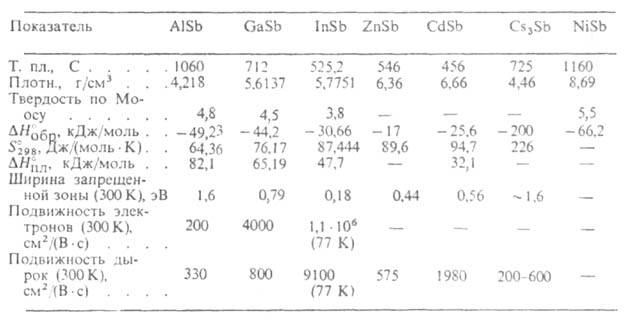
Свойства важнейших А. приведены в таблице. Антимонид алюминия AlSb-темно-серые с синеватым отливом кристаллы с металлич. блеском, решетка кубическая (а = = 0,61355 нм); перспективный материал для солнечных батарей и электронных приборов, работающих при температурах до ~500 °C. Антимонид цинка ZnSb — серые кристаллы с металлич. блеском, решетка ромбическая (а= 0,6128 нм, b = 0,7741 нм, с = 0,8115 нм, пространственная группа Pbса); материал для термоэлектрич. приборов. Антимонид цезия Cs2Sb — черные кристаллы с металлич. блеском, решетка кубическая (а = 0,9180 нм); используется для изготовления фотоэмиттеров с высоким квантовым выходом. Антимониды Cd и Mg, а также тройные соед. типа ZnSnSb2 — перспективные полупроводниковые материалы; Th3Sb4 может использоваться в качестве высокотемпературного термоэлектрич. материала; NiSb, как и др. А. с металлич. проводимостью (CrSb, CoSb), предложено использовать как компоненты эвтектич. композиций с InSb и GaSb для магнитосопротивлений, детекторов ИК-излучения и др.
Осн. опасность при работе с А. представляет SbH3, выделяющийся при действии воды или кислот на А.
• см. также галлия антимонид, индия антимонид
Лит.: Самсонов Г.В., Абдусалямова М.Н., Антимониды, Душ.. 1977.
П. И. Федоров, Р. Х. Акчурин
Значения в других словарях
- Антимониды — Соединения сурьмы с металлами. Твёрдые вещества с относительно высокой температурой плавления. Некоторые А. (Na3Sb, Ca3Sb2, Zn3Sb2 и др.) можно рассматривать как производные сурьмянистого водорода SbH3 (стибина), другие (ZnSb, SnSb, Ni4Sb, Ni5Sb и др. Большая советская энциклопедия
- АНТИМОНИДЫ — АНТИМОНИДЫ — химические соединения сурьмы с металлами. Некоторые антимониды (AlSb, GaSb, InSb) — полупроводниковые материалы. Большой энциклопедический словарь
