анзамицины
АНЗАМИЦИНЫ
антибиотики, содержащие в молекулах ароматич. ядро (нафталиновое, реже — бензольное), к которому в двух положениях присоединена алифатич. цепь из 15–20 атомов углерода. К прир. А. относятся рифамицины, стрептомицины, толипомицины, галомицин, гельданомицин, продуцируемые микроорганизмами Nocardia mediterranea, Streptomyces spectabilis, Streptomyces tolypophorus, Micromonospora halophytica, Streptomyces hygroscopicus соотв., а также майтанзиноиды (майтазин, колубринол и др.), выделенные из растений вида Maytenus и Colubrina.
А. — окрашенные (обычно желтые) кристаллы, не имеющие, как правило, четкой температуры плавления; раств. в органических растворителях (спиртах, ацетоне, CHCl3), не раств. в воде. Из культуральной жидкости выделяются экстракцией орг. растворителями.
Наиб. интерес представляют рифамицины (см. табл.), нашедшие широкое применение в медицине. Образующийся в результате биосинтеза рифамицин В (формула I) обладает сравнительно слабой биол. активностью; под действием окислителей он превращ. в рифамицин О (II; в формулах II — VI не показана алифатич. цепь, одинаковая во всех случаях); при гидролизе последнего отщепляется фрагмент гликолевой кислоты и образуется рифамицин S (III), легко восстанавливающийся аскорбиновой кислотой до рифамицина SV (IV):
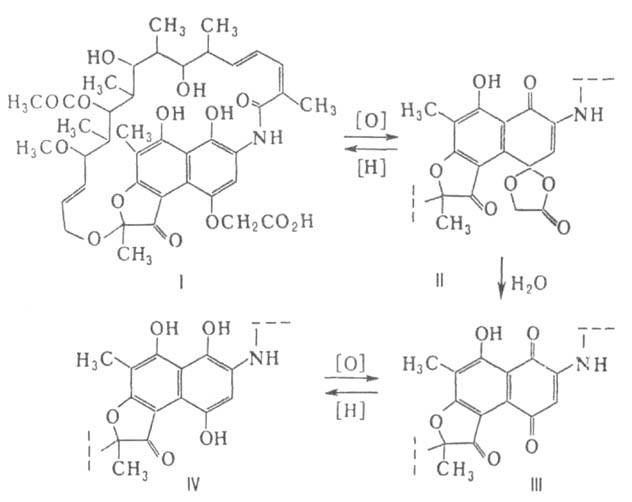
Соед. II — IV выделены из продуктов жизнедеятельности мутантных штаммов продуцента рифамицина В.
Все рифамицины — малотоксичные вещества, обладающие биол. активностью в отношении большинства грамположит. бактерий. Особенно интересна высокая активность рифамицинов в отношении микобактерий — возбудителей туберкулеза и проказы.
Синтезированы сотни модифициров. рифамицинов. Все способы модификации, приводящие к изменению конформации алифатич. цепи, сопровождаются снижением биол. активности. Изменяя строение ароматич. части молекулы, получили высокоактивные производные рифамицина В (эфиры, амиды, гидразиды) и рифамицина S (продукты конденсации с алифатич. аминами, гидразинами, о-аминофенолами, о-фенилендиаминами и др.).
Наиб. активные "полусинтетич." рифамицины получены на основе 3-формилрифамицина, или рифальдегида (V), который синтезируют взаимод. рифамицина S с формальдегидом и вторичным амином и послед. кислотным гидролизом образовавшегося аминометильного производного. Оксимы и гидразоны рифальдегида угнетают не только грамположительные, но и ряд грамотрицат. микроорганизмов. Рифампицин (VI), получаемый при взаимодействии рифальдегида с N-амино-М-метилпиперазином, обладает исключительно высокой активностью в отношении возбудителя туберкулеза и широко применяется для лечения как туберкулеза, так и других инфекц. заболеваний, в т. ч. проказы. Рифампицин — красные кристаллы (т. пл. 183–188 °C, с разл.), хорошо раств. в CHCl3 и метаноле, плохо — в ацетоне и воде. В спектре поглощения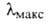 237, 254, 334 и 475 нм (при pH 7,4).
237, 254, 334 и 475 нм (при pH 7,4).
СВОЙСТВА РИФАМИЦИНОВ

Механизм антибактериального действия А. заключается в блокировании синтеза РНК в клетках болезнетворных бактерий благодаря подавлению т. наз. ДНК-зависимой РНК-полимеразы — ферментной системы, управляющей синтезом полинуклеотидов, входящих в состав РНК. Некоторые А. оказывают также противоопухолевое действие, которое, однако, недостаточно специфично и проявляется только при использовании больших доз антибиотиков.
Лит.: Мезенцев А.С, "Антибиотики", 1975, т. 20, №6, с. 560–71; Brufani M, в кн.: Topics in antibiotics chemistry, v. 1, N.Y.-[a.o.], 1977, p. 91–212.
А. С. Мезенцев
