Аррениуса уравнение
АРРЕНИУСА УРАВНЕНИЕ
температурная зависимость константы скорости к элементарной хим. реакции:
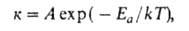
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа — энергия активации, обычно принимающая положит. значения, Т — абс. температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу, а на число частиц NA = 6,02∙1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в А.у. величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график)-прямая линия, отрицат. наклон которой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
Согласно микроскопич. кинетич. интерпретации А.у., наличие предэкспоненц. множителя А обусловлено равновесным максвелл-больцмановским распределением реагирующих частиц, а Также тем, что зависимость вероятности реакции от энергии Е этих частиц имеет пороговый характер. Последнее означает, что вероятность реакции начинает быстро возрастать, как только Е достигает некоторой величины Е0. В такой ситуации к выражается уравнением, в котором Еа заменено на Eo, а А является функцией температуры. Следовательно, А. у. — аппроксимация температурной зависимости истинной константы скорости в ограниченном температурном интервале. Для рассматриваемого процесса изменение энергии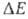 реагирующих частиц, которое вызывает заметное изменение вероятности реакции (напр., вдвое), существенно меньше средней тепловой энергии частицы kT. Если это условие не выполняется, аррениусов график отклоняется от прямой линии. Наиб. существенные отклонения от А. у. обусловлены туннельным эффектом, когда в реакцию вступают частицы с энергией много меньшей Eo, Туннельный эффект, в частности, ответствен за сильное нарушение аррениусовой зависимости константы скорости в условиях низких температур (при
реагирующих частиц, которое вызывает заметное изменение вероятности реакции (напр., вдвое), существенно меньше средней тепловой энергии частицы kT. Если это условие не выполняется, аррениусов график отклоняется от прямой линии. Наиб. существенные отклонения от А. у. обусловлены туннельным эффектом, когда в реакцию вступают частицы с энергией много меньшей Eo, Туннельный эффект, в частности, ответствен за сильное нарушение аррениусовой зависимости константы скорости в условиях низких температур (при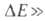 k Т), когда 1nк при увеличении 1/k Т перестает убывать и принимает постоянное значение.
k Т), когда 1nк при увеличении 1/k Т перестает убывать и принимает постоянное значение.
А. у. применимо к мн. сложным реакциям; в этих случаях Еа обычно наз. кажущейся энергией активации. Для некоторых сложных реакций аррениусов график представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
Для некоторых реакций температурная зависимость к может быть представлена в виде А.у. лишь формально, с отрицат. значением Eа. Часто это указывает на то, что в совокупность элементарных процессов, определяющих реакцию, входит равновесная стадия, для которой температурная зависимость константы равновесия К выражается уравнением:
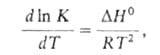
где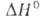 — стандартное изменение энтальпии реакции, которое может принимать как положительные, так и отрицат. значения. Уравнение было предложено С. Аррениусом в 1889.
— стандартное изменение энтальпии реакции, которое может принимать как положительные, так и отрицат. значения. Уравнение было предложено С. Аррениусом в 1889.
Е. Е. Никитин
Значения в других словарях
- Аррениуса уравнение — Математическое выражение зависимости скорости химической реакции от температуры, установленное С. А. Аррениусом в 1889. См. Кинетика химическая. Большая советская энциклопедия
- АРРЕНИУСА УРАВНЕНИЕ — АРРЕНИУСА УРАВНЕНИЕ — выражает зависимость константы скорости химической реакции k от температуры Т: k = А•ехр(-Е/RT); Е — энергия активации; R — газовая постоянная. Предложено С. Аррениусом в 1889. Большой энциклопедический словарь
