арсенаты
АРСЕНАТЫ (от лат. arsenicum — мышьяк)
соли кислородсодержащих кислот As. Различают A.(V) и А.(Ш) (устаревшее назв. — арсениты). Известны А., в которых одновременно присутствуют As(III) и As(V), напр. Cr2As As3O12.
A.(V) и А.(III)-производные соответствующих орто-мышьяковых (H3AsO4 и H3AsO3), метамышьяковых (HAsO3 и HAsO2) и полимышьяковых (напр., H4As2O7 и H4As2O5, H5As3O10, H2As4O7) кислот; в своб. виде из указанных кислот получена только H3AsO4. Наиб. распространены орто-арсенаты(V) и метаарсенаты(Ш), часто называемые просто А. В основе структуры A.(V) лежат тетраэдры AsO4, причем ортоарсенаты обычно построены из изолиров. тетраэдров, а метаарсенаты имеют цепочечную или циклич. структуру (кольца из 3 или 4 тетраэдров, соединенных вершинами). В основе структуры А.(Ш) лежат сплюснутые пирамиды AsO3, которые могут соединяться в цепи через атомы О.
Гидро- и дигидроортоарсенаты(V) при нагр. отщепляют воду и превращ. соотв. в пиро- и метаарсенаты(V). В качестве промежут. продуктов м. б. получены и др. соединения, напр.: NaH2AsO4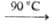 Na2H2As2O7
Na2H2As2O7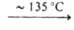
→ Na3H2As3O10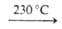 NaAsO3. При гидролизе мета- и пироарсенатов(V) образуются гидроарсенаты(V). При высоких температурах (около или выше температуры плавления) метаарсенаты(V) разлагаются до пироарсенатов(V), которые далее могут переходить в ортоарсенаты(V), обладающие наиб. термич. устойчивостью. При термич. разложении последних могут образовываться оксоарсенаты(V). Безводные А.(Ш) при 300–550 °C диспропорционируют с образованием A.(V) и As. Метаарсенаты(Ш) могут предварительно разлагаться до пиро- или ортоарсенатов(Ш) с отщеплением As2O3.
NaAsO3. При гидролизе мета- и пироарсенатов(V) образуются гидроарсенаты(V). При высоких температурах (около или выше температуры плавления) метаарсенаты(V) разлагаются до пироарсенатов(V), которые далее могут переходить в ортоарсенаты(V), обладающие наиб. термич. устойчивостью. При термич. разложении последних могут образовываться оксоарсенаты(V). Безводные А.(Ш) при 300–550 °C диспропорционируют с образованием A.(V) и As. Метаарсенаты(Ш) могут предварительно разлагаться до пиро- или ортоарсенатов(Ш) с отщеплением As2O3.
А. щелочных металлов, а также гидроарсенаты(V) щел.-зем. и некоторых тяжелых металлов раств. в воде, А.(Ш) щел.-зем. металлов малорастворимы, все остальные А. практически не раств. в воде. А. разлагаются минер. кислотами и растворами щелочей. А.(Ш) в щелочных растворах — сильные восстановители.
А. известны для всех металлов, кроме Au и металлов платиновой группы. Щелочные металлы образуют безводные мета-, пиро- и ортоарсенаты(V), плавящиеся конгруэнтно, и триарсенаты, плавящиеся инконгруэнтно. Щел.-зем. и др. металлы в степени окисления + 2 в отсутствие воды образуют мета-, пиро- и ортоарсенаты(V), а также оксоарсенаты(V), напр. состава 6MO*As2O5. Из А.(III) чаще других встречаются MII(AsO2)2 и MII3(AsO3)2.
Для элементов в степени окисления + 3 характерно образование ортоарсенатов(V). А.(III), выделенные из водных растворов, обычно имеют состав M(AsO2)3*nH2O, полученные в отсутствие воды — МAsO3. Для элементов в степени окисления + 4 характерны гидроарсенаты(V) и пироарсенаты(V). Примеры A.(V) металлов в степени окисления + 5: NbOAsO4*4H2O и NbO(HAsO4)3 *5H2O.
Существуют двойные А., напр. М М AsO4, MIMIII (AsO4)2. Из А., содержащих др. анионы, наиб. изучены M5II(AsO4)3X, где Х-OH−, F−, Cl− и др. Известно ок. 85 прир. минералов, относящихся к A.(V): скородит FeAsO4*2H2O, эритрин Co3(AsO4)2*8H2O, оли-венит Cu2AsO4(OH), миметизит Pbs(AsO4)3Cl и др. Природные А.(III) — очень редкие минералы, напр. армангит Mn3(AsO3)2.
А. получают в осн. взаимод. оксидов As или растворов мышьяковых кислот с оксидами, гидроксидами или карбонатами металлов, А. тяжелых металлов — реакцией их солей с Na3AsO4 или NaAsO2 (иногда с Li3AsO4 или LiAsO2) в растворе. A.(V) синтезируют также окислением А.(III).
А. — диэлектрики или полупроводники с большой шириной запрещенной зоны. Многие, напр. KH2AsO4 или арсенаты РЗЭ,-сегнето- и пьезоэлектрики. Некоторые А. — антиферромагнетики. Среди А. есть и твердые электролиты, напр. Ag7I4AsO4, NaZr2(AsO4)3.
Гидроарсенат(V) натрия Na2HASO4*7H2O — бесцветные кристаллы; т. пл. 57 °C (см также табл.); раств. в воде, спирте и глицерине, не раств. в эфире. Получают нагреванием смеси As2O3 с NaNO3 с послед. гидролизом и перекристаллизацией из водного раствора или окислением раствора NaAsO2 кислородом воздуха в присутствии CuSO4 либо анодным окислением. Инсектицид, антисептическое средство.
Дигидроарсенат(V) калия К.H2AsO4 — бесцветные кристаллы, решетка тетрагональная (а = 0,76290 нм, с = = 0,71612 нм, z = 4, пространств, группы I42d); не раств. в спирте, раств. в воде и глицерине. Это соединение, как и А. аммония, Rb, Cs, — материал нелинейной оптики.
СВОЙСТВА АРСЕНАТОВ
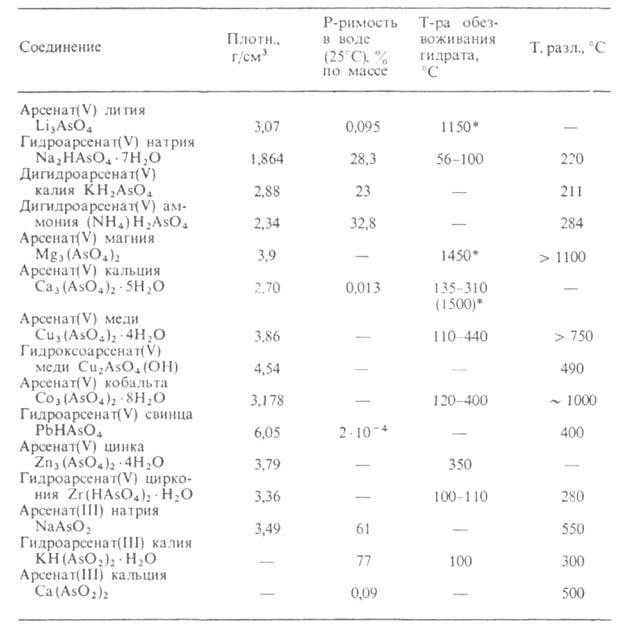
* Температура плавления безводной соли.
Гидроарсенат(V) свинца PbHAsO4 — белые кристаллы. Подобно арсенатам Ca, Zn, Cu, Mg- инсектицид и фунгицид, антисептич. средство для пропитки древесины, компонент необрастающих красок для судов.
Арсенат(V) кобальта Co3(AsO4)2*8H2O — розовые кристаллы. Пигмент для росписи на стекле и фарфоре, компонент шихты в производстве цветного стекла.
Арсенат(Ш) кальция. Техн. продукт — смесь метаарсената(Ш) Ca(AsO2)2 с ортоарсенатом(Ш) Ca3(AsO3)2. Получают взаимод. As2O3 с Ca(OH)2 при нагревании. Инсектицид, бактерицидное средство, компонент смеси для протравливания семян, необрастающих красок для судов.
Гидроксоарсенат(Ш) меди (зелень Шееле) Cu3(AsO3)2*nCu(OH)2*mH2O (где и = 1 — 3) — желтовато-зеленое или темно-зеленое твердое вещество; не раств. в воде и спирте. Получают взаимод. CuSO4, As2O3 и Na2CO3 в водном растворе. Арсенат(Ш)-ацетат меди (парижская, или швейнфуртская, зелень) Cu4(AsO2)6(CH3CO2)2 — изумрудно-зеленое твердое вещество; плотн. ~ 3,2 г/см3; не раств. в воде и спирте, водой постепенно гидролизуется с отщеплением As2O3. Получают взаимод. растворов CuSO4, CH3CO2Na и NaAsO2 или действием CH3CO2Н и As2O3 на Cu2(OH)2CO3 при нагревании. Оба соед. — инсектициды и фунгициды, компоненты необрастающих красок для судов, пигменты для художеств. красок. А., в особенности водорастворимые, — сильные яды.
Лит.: Рцхиладзе В. Г., Мышьяк, М., 1969; Позин М. Е., Технология минеральных солей ..., 4 изд., ч. 2, Л., 1974, с. 1396–1429; Keller P., "Neues Jahrbuch fur Mjneralogie Monatshefte", 1971, H. 11, S. 419–510.
П. И. Федоров
Значения в других словарях
- Арсенаты — Соли мышьяковой кислоты H3AsO4 (см. Мышьяк). А. кальция применяют для борьбы с вредителями с.-х. растений. Большая советская энциклопедия
