атмосферная коррозия
АТМОСФЕРНАЯ КОРРОЗИЯ
разрушение металлов под действием приземного слоя атмосферы. Скорость процесса зависит от климатич. факторов (гл. обр. влажности и температуры воздуха) и концентрации примесей, загрязняющих атмосферу (оксиды серы, азота, выбросы хим. производств и др.). Различают сухую, влажную и мокрую А.к. Сухая А.к. происходит при относит. влажности воздуха ниже некоторой критической ( < 70% для чистой атмосферы). При наличии в атмосфере примесей, способных образовывать гидраты с малым парциальным давлением водяных паров, граница критич. влажности смещается к более низким значениям.
Сухая А. к. протекает по механизму низкотемпературного окисления, включающему след. стадии: хемосорбция O2 и H2O на поверхности металла с их диссоциацией; образование зародышей кристаллизации оксидов и гидроксидов металла, тангенциальный рост кристаллов, слияние и образование сплошной, частично гидратированной оксидной пленки. При толщине пленки 2–5 нм дальнейшее окисление металла в чистой (без примесей) атмосфере прекращается.
Влажная А.к. развивается при относит. влажности выше критической, т. е. > 70% для чистой атмосферы, когда на поверхности металла возникает тонкая (от 2–3 до десятков молекулярных слоев) адсорбц. пленка воды, и происходит по электрохим. механизму. Катодная реакция имеет вид:
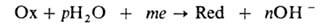 "
"
где п, m, р-стехиометрич. коэф. электрохим. восстановления, Ох — O2, O3, H2O2 и др. окислители, Red — их восстановленная форма (м. б. заряженной). Металл М окисляется по анодной реакции:
 Э
Э
где Az− — анион (OH−, SO42−, Cl− и др.), образующийся при растворении в воде примесей. В чистой атмосфере продукты анодной реакции — труднорастворимые гидроксиды, из которых формируется плотная защитная пленка, препятствующая дальнейшему развитию А. к. (металл пассивируется). Примеси, способные растворяться в воде, активируют анодную реакцию вследствие образования легкорастворимых солей. Поэтому скорость влажной А. к. в загрязненной атмосфере в сотни и тысячи раз больше, чем в чистой.
Мокрая А. к. наблюдается при возникновении на поверхности металла фазовой (капельно-жидкой) пленки воды в результате выпадения дождя, конденсации атм. влаги (роса) или осаждения тумана и протекает по такому же электрохим. механизму коррозии, как и в объемах электролитов. В начальных стадиях скорость А. к. трудно пассивирующихся металлов определяется скоростью катодной реакции, но по мере накопления продуктов анодного растворения ионизация металла замедляется и скорость А.к. уменьшается. Увеличение концентрации примесей в пленке воды стимулирует коррозию.
В реальных условиях наблюдаются все рассмотренные виды А. к. Защитные свойства слоя продуктов А. к., предохраняющего металл от дальнейшего разрушения, можно усилить легированием металла Ni, Cu, Cr (низколегированные атмосферостойкие стали, сплавы на основе Cu, А1 и др.). Для А.к. характерны все виды коррозионного разрушения: равномерное, язвенное, питтинговое, щелевое, межкристаллитное, коррозионное растрескивание и др. По стойкости к А. к. металлы и сплавы образуют ряд в такой же последовательности, как и по стойкости к коррозии в нейтральных электролитах, а именно: благородные металлы, легко пассивирующиеся металлы (Ti, A( Zr), конструкц. сплавы на основе Fe, Ni, Cu, Cd.
Для техн. целей коррозионную агрессивность атмосферы оценивают по климатич. характеристикам и загрязненности. Осн. климатич. характеристика — продолжительность сохранения на металлах адсорбционных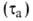 или фазовых
или фазовых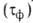 пленок воды. Соотв. различают климат сухой (
пленок воды. Соотв. различают климат сухой (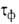 500 ч/год), умеренно влажный (500 <
500 ч/год), умеренно влажный (500 < 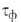 < 2500) и влажный (
< 2500) и влажный (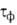 > 2500). Скорость А.к. [г/(м2*год)] приближенно рассчитывают по уравнению:
> 2500). Скорость А.к. [г/(м2*год)] приближенно рассчитывают по уравнению:
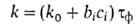 9
9
где k0- скорость коррозии металла в сельской (условно чистой) атмосфере, bi,-ускорение коррозии примесью частиц i-ro сорта, ci-концентрация этой примеси. Реальная скорость А. к. низкоуглеродистой стали от 30 (в сухой сельской атмосфере) до 8000 (в морской атмосфере), меди — от 1,7 до 65, цинка — от 1 до 95 г/(м2*год).
Металлы защищают от А. к. с помощью гальванич., металлизационных и лакокрасочных покрытий. Широко используют консервацию смазками и полимерными покрытиями, применяют летучие и контактные ингибиторы коррозии.
Лит.: Розенфельд И. Л., Атмосферная коррозия металлов, М., 1960; Михайловский Ю. Н., в кн.: Итога науки и техники. Коррозия и защита от коррозии, т. 3, М., 1974, с. 153–205; Михайловский Ю. Н. [и др.]. "Защита металлов", 1980, т. 16, в. 4, с. 396–413.
Ю. Н. Михайловский
