атом
АТОМ (от греч. atomos — неделимый)
наименьшая частица хим. элемента, носитель его свойств. Каждому хим. элементу соответствует совокупность определенных А. Связываясь друг с другом, А. одного или разных элементов образуют более сложные частицы, напр. молекулы. Все многообразие хим. веществ (твердых, жидких и газообразных) обусловлено разл. сочетаниями А. между собой. А. могут существовать и в своб. состоянии (в газе, плазме). Свойства А., в т. ч. важнейшая для химии способность А. образовывать хим. соед., определяются особенностями его строения.
Общая характеристика строения атома. А. состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры А. в целом определяются размерами его электронного облака и велики по сравнению с размерами ядра А. (линейные размеры А. ~ 10−8 см, его ядра ~ 10−12 — 10−13 см). Электронное облако А. не имеет строго определенных границ, поэтому размеры А. в значит. степени условны и зависят от способов их определения (см. атомные радиусы). Ядро А. состоит из Z протонов и N нейтронов, удерживаемых ядерными силами (см. ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60∙10−19 Кл; нейтрон не обладает электрич. зарядом. Заряд ядра +Ze — осн. характеристика А., обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном А. число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li+, Li2+ или О−, О2−. Говоря об А. определенного элемента, подразумевают как нейтральные А., так и ионы этого элемента.
Масса А. определяется массой его ядра; масса электрона (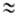 9,109∙10−28 г) примерно в 1840 раз меньше массы протона или нейтрона (
9,109∙10−28 г) примерно в 1840 раз меньше массы протона или нейтрона (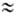 1,67∙10−24 г), поэтому вклад электронов в массу А. незначителен. Общее число протонов и нейтронов А = Z + N наз. массовым числом. Массовое число и заряд ядра указываются соотв. верхним и нижним индексами слева от символа элемента, напр. 2311Na. Вид атомов одного элемента с определенным значением N наз. нуклидом. А. одного и того же элемента с одинаковыми Z и разными N наз. изотопами этого элемента. Различие масс изотопов мало сказывается на их хим. и физ. свойствах. Наиболее значит, отличия (изотопные эффекты) наблюдаются у изотопов водорода вследствие большой относит. разницы в массах обычного атома
1,67∙10−24 г), поэтому вклад электронов в массу А. незначителен. Общее число протонов и нейтронов А = Z + N наз. массовым числом. Массовое число и заряд ядра указываются соотв. верхним и нижним индексами слева от символа элемента, напр. 2311Na. Вид атомов одного элемента с определенным значением N наз. нуклидом. А. одного и того же элемента с одинаковыми Z и разными N наз. изотопами этого элемента. Различие масс изотопов мало сказывается на их хим. и физ. свойствах. Наиболее значит, отличия (изотопные эффекты) наблюдаются у изотопов водорода вследствие большой относит. разницы в массах обычного атома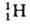 (протия), дейтерия D
(протия), дейтерия D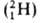 и трития Т
и трития Т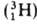 . Точные значения масс А. определяют методами масс-спектрометрии.
. Точные значения масс А. определяют методами масс-спектрометрии.
Квантовые состояния атома. Благодаря малым размерам и большой массе ядро А. можно приближенно считать точечным и покоящимся в центре масс А. и рассматривать А. как систему электронов, движущихся вокруг неподвижного центра — ядра. Полная энергия такой системы Е равна сумме кинетич. энергий Т всех электронов и потенциальной энергии U, которая складывается из энергии притяжения электронов ядром и энергии взаимного отталкивания электронов друг от друга. А. подчиняется законам квантовой механики; его осн. характеристика как квантовой системы — полная энергия Е — может принимать лишь одно из значений дискретного ряда Е1 < Е2 < Е3 < ...; промежут. значениями энергии А. обладать не может. Каждому из "разрешенных" значений Е соответствует одно или неск. стационарных (с не изменяющейся во времени энергией) состояний А. Энергия Е может изменяться только скачкообразно — путем квантового перехода А. из одного стационарного состояния в другое. Методами квантовой механики можно точно рассчитать Е для одноэлектронных А. — водорода и водородоподобных: Е= —hcRZ2/n2, где h — постоянная Планка, с-скорость света, целое число n = 1, 2, 3, ... определяет дискретные значения энергии и наз. главным квантовым числом; R-постоянная Ридберга (hcR = 13,6 эВ). При использовании СИ формула для выражения дискретных уровней энергии одноэлектронных А. записывается в виде:
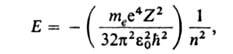
где те- масса электрона, 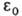 -электрич. постоянная,
-электрич. постоянная, 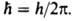 Возможные "разрешенные" значения энергии электронов в А. изображают в виде схемы уровней энергии — горизонтальных прямых, расстояния между которыми соответствуют разностям этих значений энергий (рис. 1). Наиб. низкий уровень E1, отвечающий минимально возможной энергии, наз. основным, все остальные — возбужденными. Аналогично наз. состояния (основное и возбужденные), которым соответствуют указанные уровни энергии. С ростом n уровни сближаются и при
Возможные "разрешенные" значения энергии электронов в А. изображают в виде схемы уровней энергии — горизонтальных прямых, расстояния между которыми соответствуют разностям этих значений энергий (рис. 1). Наиб. низкий уровень E1, отвечающий минимально возможной энергии, наз. основным, все остальные — возбужденными. Аналогично наз. состояния (основное и возбужденные), которым соответствуют указанные уровни энергии. С ростом n уровни сближаются и при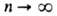 энергия электрона приближается к значению, отвечающему своб. (покоящемуся) электрону, удаленному из А. Квантовое состояние А. с энергией Е полностью описывается волновой функцией
энергия электрона приближается к значению, отвечающему своб. (покоящемуся) электрону, удаленному из А. Квантовое состояние А. с энергией Е полностью описывается волновой функцией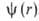 , где r-радиус-вектор электрона относительно ядра. Произведение
, где r-радиус-вектор электрона относительно ядра. Произведение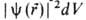 равно вероятности нахождения электрона в объеме dV, то есть
равно вероятности нахождения электрона в объеме dV, то есть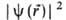 — плотность вероятности (электронная плотность). Волновая функция
— плотность вероятности (электронная плотность). Волновая функция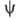 определяется уравнением Шрёдингера
определяется уравнением Шрёдингера 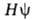 =
=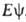 , где R — оператор полной энергии (гамильтониан).
, где R — оператор полной энергии (гамильтониан).
Наряду с энергией движение электрона вокруг ядра (орбитальное движение) характеризуется орбитальным моментом импульса (орбитальным мех. моментом) М1; квадрат его величины может принимать значения, определяемые орбитальным квантовым числом l = 0, 1, 2, ...; 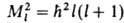 , где
, где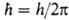 . При заданном и квантовое число l может принимать значения от 0 до (и — 1). Проекция орбитального момента на некоторую ось z также принимает дискретный ряд значений Мlz =
. При заданном и квантовое число l может принимать значения от 0 до (и — 1). Проекция орбитального момента на некоторую ось z также принимает дискретный ряд значений Мlz =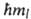 , где ml-магнитное квантовое число, имеющее дискретные значения от — l до +l(-l,... — 1, О, 1, ... + l), всего 2l + 1 значений. Ось z для А. в отсутствие внеш. сил выбирается произвольно, а в магн. поле совпадает с направлением вектора напряженности поля. Электрон обладает также собственным моментом импульса -спином и связанным с ним спиновым магн. моментом. Квадрат спинового мех. момента МS2 =
, где ml-магнитное квантовое число, имеющее дискретные значения от — l до +l(-l,... — 1, О, 1, ... + l), всего 2l + 1 значений. Ось z для А. в отсутствие внеш. сил выбирается произвольно, а в магн. поле совпадает с направлением вектора напряженности поля. Электрон обладает также собственным моментом импульса -спином и связанным с ним спиновым магн. моментом. Квадрат спинового мех. момента МS2 =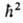 S(S + 1) определяется спиновым квантовым числом S = 1/2, а проекция этого момента на ось z Msz = =
S(S + 1) определяется спиновым квантовым числом S = 1/2, а проекция этого момента на ось z Msz = =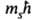 -квантовым числом ms, принимающим полуцелые значения ms=1/2 и ms = -1/2.
-квантовым числом ms, принимающим полуцелые значения ms=1/2 и ms = -1/2.
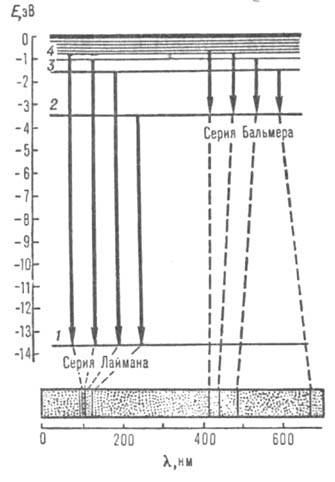
Рис. 1. Схема уровней энергии атома водорода (горизонтальные линии) и оптич. переходов (вертикальные линии). Внизу изображена часть атомного спектра испускания водорода — две серии спектральных линий; пунктиром показано соответствие линий и переходов электрона.
Стационарное состояние одноэлектронного А. однозначно характеризуется четырьмя квантовыми числами: п, l, ml и ms. Энергия А. водорода зависит только от п, и уровню с заданным n соответствует ряд состояний, отличающихся значениями l, ml, ms. Состояния с заданными n и l принято обозначать как 1s, 2s, 2p, 3s и т. д., где цифры указывают значения л, а буквы s, p, d, f и дальше по латинскому алфавиту соответствуют значениям д = 0, 1, 2, 3, ... Число разл. состояний с заданными n и д равно 2(2l+ 1) числу комбинаций значений ml и ms. Общее число разл. состояний с заданным n равно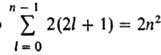 , т. е. уровням со значениями n = 1, 2, 3, ... соответствуют 2, 8, 18, ..., 2n2 разл. квантовых состояний. Уровень, которому соответствует лишь одно квантовое состояние (одна волновая функция), наз. невырожденным. Если уровню соответствует два или более квантовых состояний, он наз. вырожденным (см. вырождение энергетических уровней). В А. водорода уровни энергии вырождены по значениям l и ml; вырождение по ms имеет место лишь приближенно, если не учитывать взаимод. спинового магн. момента электрона с магн. полем, обусловленным орбитальным движением электрона в электрич. поле ядра (см. спин-орбитальное взаимодействие). Это — релятивистский эффект, малый в сравнении с кулоновским взаимод., однако он принципиально существен, т. к. приводит к дополнит. расщеплению уровней энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
, т. е. уровням со значениями n = 1, 2, 3, ... соответствуют 2, 8, 18, ..., 2n2 разл. квантовых состояний. Уровень, которому соответствует лишь одно квантовое состояние (одна волновая функция), наз. невырожденным. Если уровню соответствует два или более квантовых состояний, он наз. вырожденным (см. вырождение энергетических уровней). В А. водорода уровни энергии вырождены по значениям l и ml; вырождение по ms имеет место лишь приближенно, если не учитывать взаимод. спинового магн. момента электрона с магн. полем, обусловленным орбитальным движением электрона в электрич. поле ядра (см. спин-орбитальное взаимодействие). Это — релятивистский эффект, малый в сравнении с кулоновским взаимод., однако он принципиально существен, т. к. приводит к дополнит. расщеплению уровней энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
При заданных n, l и ml квадрат модуля волновой функции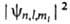 определяет для электронного облака в А. среднее распределение электронной плотности. Разл. квантовые состояния А. водорода существенно отличаются друг от друга распределением электронной плотности (рис. 2). Так, при l = 0 (s-состояния) электронная плотность отлична от нуля в центре А. и не зависит от направления (т. е. сферически симметрична), для остальных состояний она равна нулю в центре А. и зависит от направления.
определяет для электронного облака в А. среднее распределение электронной плотности. Разл. квантовые состояния А. водорода существенно отличаются друг от друга распределением электронной плотности (рис. 2). Так, при l = 0 (s-состояния) электронная плотность отлична от нуля в центре А. и не зависит от направления (т. е. сферически симметрична), для остальных состояний она равна нулю в центре А. и зависит от направления.

Рис. 2. Форма электронных облаков для различных состояний атома водорода.
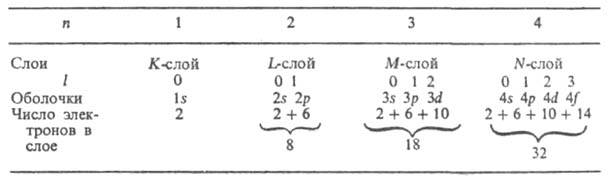
В многоэлектронных А. вследствие взаимного электростатич. отталкивания электронов существенно уменьшается прочность их связи с ядром. Например, энергия отрыва электрона от иона Не+ равна 54,4 эВ, в нейтральном атоме Не она значительно меньше — 24,6 эВ. Для более тяжелых А. связь внеш. электронов с ядром еще слабее. Важную роль в многоэлектронных А. играет специфич. обменное взаимодействие, связанное с неразличимостью электронов, и тот факт, что электроны подчиняются Паули принципу, согласно которому в каждом квантовом состоянии, характеризуемом четырьмя квантовыми числами, не может находиться более одного электрона. Для многоэлектронного А. имеет смысл говорить только о квантовых состояниях всего А. в целом. Однако приближенно, в т. наз. одноэлектронном приближении, можно рассматривать квантовые состояния отдельных электронов и характеризовать каждое одноэлектронное состояние (определенную орбиталь, описываемую соответствующей функцией) совокупностью четырех квантовых чисел n, l, ml и ms. Совокупность 2(2l+ 1) электронов в состоянии с данными n и l образует электронную оболочку (наз. также подуровнем, подоболочкой); если все эти состояния заняты электронами, оболочка наз. заполненной (замкнутой). Совокупность 2п2 состояний с одним и тем же n, но разными l образует электронный слой (наз. также уровнем, оболочкой). Для п= 1, 2, 3, 4, ... слои обозначают символами К, L, M, N, ... Число электронов в оболочках и слоях при полном заполнении приведены в таблице:
Прочность связи электрона в А., т. е. энергия, которую необходимо сообщить электрону, чтобы удалить его из А., уменьшается с увеличением п, а при данном п — с увеличением l. Порядок заполнения электронами оболочек и слоев в сложном А. определяет его электронную конфигурацию, т. е. распределение электронов по оболочкам в основном (невозбужденном) состоянии этого А. и его ионов. При таком заполнении последовательно связываются электроны с возрастающими значениями и и /. Например, для А. азота (Z = 7) и его ионов N+, N2+, N3+, N4+, N5+ и N6+ электронные конфигурации имеют вид соотв.: Is22s22p3; Is22s22p2; Is22s22p; Is22s2; Is22s; Is2; Is (число электронов в каждой оболочке указывается индексом справа сверху). Такие же электронные конфигурации, как и у ионов азота, имеют нейтральные А. элементов с тем же числом электронов: С, В, Be, Li, He, Н (Z = 6, 5, 4, 3, 2, 1). Начиная с n = 4 порядок заполнения оболочек изменяется: электроны с большим п, но меньшим l оказываются связанными прочнее, чем электроны с меньшим n и большим l (правило Клечковского), напр. 4s-электроны связаны прочнее 3d-электронов, и сперва заполняется оболочка 4s, а затем 3d. При заполнении оболочек 3d, 4d, 5d получаются группы соответствующих переходных элементов; при заполнении 4f- и 5f-оболочек — соотв. лантаноиды и актиноиды. Порядок заполнения обычно соответствует возрастанию суммы квантовых чисел (n + l); при равенстве этих сумм для двух или более оболочек сначала заполняются оболочки с меньшим и. Имеет место след. последовательность заполнения электронных оболочек:
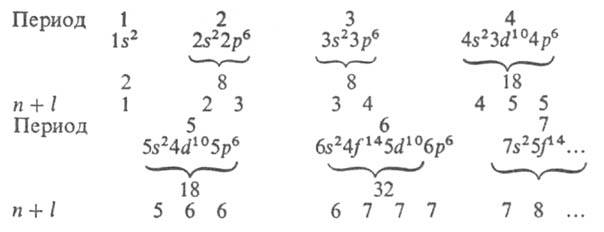
Для каждого периода указаны электронная конфигурация благородного газа, макс. число электронов, а в последней строке приведены значения n + l. Имеются, однако, отступления от этого порядка заполнения (подробнее о заполнении оболочек см. периодическая система химических элементов).
Между стационарными состояниями в А. возможны квантовые переходы. При переходе с более высокого уровня энергии Еi на более низкий Ek А. отдает энергию (Ei — Ek), при обратном переходе получает ее. При излучательных переходах А. испускает или поглощает квант электромагн. излучения (фотон). Возможны и безызлучательные переходы, когда А. отдает или получает энергию при взаимодействии с др. частицами, с которыми он сталкивается (напр., в газах) или длительно связан (в молекулах, жидкостях и твердых телах). В атомарных газах в результате столкновения своб. А. с др. частицей он может перейти на др. уровень энергии — испытать неупругое столкновение; при упругом столкновении изменяется лишь кинетич. энергия постулат. движения А., а его полная внутр. энергия Е остается неизменной. Неупругое столкновение своб. А. с быстро движущимся электроном, отдающим этому А. свою кинетич. энергию, — возбуждение А. электронным ударом — один из методов определения уровней энергии А.
Строение атома и свойства веществ. Хим. свойства определяются строением внеш. электронных оболочек А., в которых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек А. хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. свойств этих элементов. При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому А. с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в химических реакциях. А., которым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. А. благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. реакции.
Строение внутр. оболочек А., электроны которых связаны гораздо прочнее (энергия связи 102–104 эВ), проявляется лишь при взаимодействии А. с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов, нейтронов) на А. (см. дифракционные методы). Масса А. определяет такие его физ. свойства, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра А. зависят некоторые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см. спектроскопия).
Более слабые по сравнению с хим. связью электростатич. взаимод. двух А. проявляются в их взаимной поляризуемости — смещении электронов относительно ядер и возникновении поляризац. сил притяжения между А. (см. межмолекулярные взаимодействия). А. поляризуется и во внеш. электрич. полях; в результате уровни энергии смещаются и, что особенно важно, вырожденные уровни расщепляются (см. Штарка эффект). А. может поляризоваться также под действием электрич. поля волны электромагн. излучения; поляризация зависит от частоты излучения, что обусловливает зависимость от нее показателя преломления вещества, связанного с поляризуемостью А. Тесная связь оптич. свойств А. с его электрич. свойствами особенно ярко проявляется в оптич. спектрах.
Внеш. электроны А. определяют и магн. свойства вещества. В А. с заполненными внеш. оболочками его магн. момент, как и полный момент импульса (мех. момент), равен нулю. А. с частично заполненными внеш. оболочками обладают, как правило, постоянными магн. моментами, отличными от нуля; такие вещества парамагнитны (см. парамагнетики). Во внеш. магн. поле все уровни энергии А., для которых магн. момент не равен нулю, расщепляются (см. Зеемана эффект). Все А. обладают диамагнетизмом, который обусловлен возникновением у них индуцированного магн. момента под действием внеш. магн. поля (см. диэлектрики).
Свойства А., находящегося в связанном состоянии (напр., входящего в состав молекул), отличаются от свойств своб. А. наиб. изменения претерпевают свойства, определяемые внеш. электронами, принимающими участие в хим. связи; свойства, определяемые электронами внутр. оболочек, могут при этом практически не изменяться. Некоторые свойства А. могут испытывать изменения, зависящие от симметрии окружения данного атома. Примером может служить расщепление уровней энергии А. в кристаллах и комплексных соед., которое происходит под действием электрич. полей, создаваемых окружающими ионами или лигандами.
Лит.: Карапетьянц М. X., Дракин С.И., Строение вещества, 3 изд., М., 1978; Шло лье кий Э. В., Атомная физика, 7 изд., т. 1–2, М., 1984.
М. А. Ельяшевич
Значения в других словарях
- АТОМ — (от греч. atomos — неделимый), часть в-ва микроскопич. размеров и массы (микрочастица), наименьшая часть хим. элемента, являющаяся носителем его св-в. Каждому хим. элементу соответствует определ. род А., обозначаемый хим. символом. Физический энциклопедический словарь
- атом — орф. атом, -а Орфографический словарь Лопатина
- атом — -а, м. Наименьшая частица химического элемента, которая является носителем его химических свойств. ◊ - меченые атомы [От греч. ’άτομος — неделимый] Малый академический словарь
- Атом — Минимальный ненулевой элемент частично упорядоченного множества с нулем 0, т. е. такой элемент р, что влечет . л. А. Скорняков. Математическая энциклопедия
- Атом — (от греч. atomos — неделимый) частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род... Большая советская энциклопедия
- атом — Самая маленькая устойчивая частица химического элемента. Атом обычно имеет размеры около 0,1 нм. Почти вся его масса сконцентрирована в положительно заряженном ядре, которое примерно в тысячу раз меньше всего атома. Большой астрономический словарь
- атом — АТОМ -а м. atome m. 1. Мельчайшая неделимая частица вещества. Атомы не могут быть вечны. Кантемир О природе. Ампер полагает, что каждая неделимая частица материи (атом) содержит неотъемлемое от нея количество электричества. ОЗ 1848 56 8 240. Словарь галлицизмов русского языка
- атом — см. >> малость Словарь синонимов Абрамова
- атом — А́том/. Морфемно-орфографический словарь
- атом — Заимств. в Петровскую эпоху из греч. яз., в котором atomos «неделимый» — из a «не» и temnō «делю, ломаю». Атом до середины XIX в. ученые считали неделимой частицей вещества. Этимологический словарь Шанского
- АТОМ — АТОМ, мельчайшая частица вещества, которая может вступать в химические реакции. У каждого вещества имеется характерный только для него набор атомов. Научно-технический словарь
- атом — • Зыбкий (Бальмонт). • Яйцевидный (Бальмонт). Словарь литературных эпитетов
- атом — АТОМ -а; м. [от греч. atomos — неделимый]. 1. Мельчайшая частица химического элемента, сохраняющая его свойства. Строение атома. Меченые атомы (изотопы, применяемые при изучении процессов, происходящих в биологических, механических системах). 2. Публиц. Толковый словарь Кузнецова
- атом — АТОМ м. греч. неделимое; вещество в крайних пределах делимости своей, незримая пылинка, из каких будто бы составлены все тела, всякое вещество, как бы из песчинок. || Неизмеримая, бесконечно малая пылинка, ничтожное количество. Толковый словарь Даля
- атом — атом I м. 1. Мельчайшая электрически нейтральная частица химического элемента, являющаяся носителем его свойств. 2. разг. Атомная энергия. II м. Мельчайшая структурная единица чего-либо; частица. Толковый словарь Ефремовой
- АТОМ — АТОМ (от греч. atomos — неделимый) — мельчайшая частица химического элемента, сохраняющая его свойства. В центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома; вокруг движутся электроны... Большой энциклопедический словарь
- атом — ’АТОМ, атома, ·муж. (·греч. atomos, ·букв. неделимый). Мельчайшая частица материи (в атомистической теории предполагалась неделимой; ·ест. ). Молекула воды состоит из двух атомов водорода и одного атома кислорода. | перен. Толковый словарь Ушакова
- атом — Атома, м. [греч. atomos, букв. неделимый]. Мельчайшая частица материи (в атомистической теории предполагалась неделимой; ест.). Молекула воды состоит из двух атомов водорода и одного атома кислорода. || перен. Ничтожная величина, одна из многих незначительных частей какого-н. целого (книжн.). Большой словарь иностранных слов
- атом — АТОМ, а, м. Мельчайшая частица химического элемента, состоящая из ядра и электронов. | прил. атомный, ая, ое и атомарный, ая, ое. Атомный вес. Атомное ядро. Атомная физика (раздел физики, в к-ром изучается строение и состояние атомов). Атомная энергия. Толковый словарь Ожегова
