азота оксиды
АЗОТА ОКСИДЫ
Гемиоксид N2O (оксид диазота, "веселящий газ") имеет слабый приятный запах и сладковатый вкус (см. табл.). Молекула линейна (длины связей в нм): Для N2O μ 0,51∙10−30 Кл∙м. Растворимость в воде (г на 100 г): 0,257 (0 °C) и 0,108 (25 °C); раств.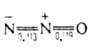 в спирте, эфире, H2SO4. С водой, растворами кислот и щелочей, кислородом не взаимод. Выше 500 °C с заметной скоростью разлагается на N2 и O2 и проявляет сильные окислит. свойства (в N2O, как и в O2, вспыхивает тлеющая лучина). Раствор H2SO3 восстанавливает N2O до N2, соли 8n2+ — до NH2OH, соли Ti3+ — до NH3. С H2, NH3, CO, а также с орг. веществами N2O образует взрывоопасные смеси. Получают N2O разложением NH4NO3 при 250 °C. Процесс экзотермичен и протекает с ускорением (при быстром нагревании возможен взрыв).
в спирте, эфире, H2SO4. С водой, растворами кислот и щелочей, кислородом не взаимод. Выше 500 °C с заметной скоростью разлагается на N2 и O2 и проявляет сильные окислит. свойства (в N2O, как и в O2, вспыхивает тлеющая лучина). Раствор H2SO3 восстанавливает N2O до N2, соли 8n2+ — до NH2OH, соли Ti3+ — до NH3. С H2, NH3, CO, а также с орг. веществами N2O образует взрывоопасные смеси. Получают N2O разложением NH4NO3 при 250 °C. Процесс экзотермичен и протекает с ускорением (при быстром нагревании возможен взрыв).
СВОЙСТВА ОКСИДОВ АЗОТА

* Цвет кристаллов. ** Температура возгонки.
Монооксид NO парамагнитен и склонен к димериза-ции (жидкий NO содержит 25% димера, твердый целиком состоит из него). Длина связи N—О 0,115 нм, энергия связи 626,84 кДж/моль; μ 6,48∙10− 30 Кл * м;  димеризации −11,2 кДж/моль. Растворимость в воде (г на 100 г): 0,00988 (0 °C) и 0,00348 (100 °C); раств. в спирте, CS2 и H2SO4.
димеризации −11,2 кДж/моль. Растворимость в воде (г на 100 г): 0,00988 (0 °C) и 0,00348 (100 °C); раств. в спирте, CS2 и H2SO4.
Ниже 1000 °C NO практически не разлагается. Равновесные концентрации NO, получающегося по реакции N2 + О,  2NO, составляют (в %): 0,61 (2000 °C), 4,48 (3200 °C), 10,00 (4200 °C) С водой, разб. растворами кислот и щелочей не взаимод. При обычных условиях быстро окисляется до NO2, с повышением температуры скорость реакции уменьшается. Это обусловлено тем, что с O2 взаимод. молекулы димера N2O2, содержание которого с повышением температуры уменьшается. Присоединяет галогены с образованием нитрозилгалогени-дов NOHal. С H2SO4 в присутствии воздуха дает нитрозилсер-ную кислоту (NO)HSO4. Восстанавливается углеродом, фосфором, серой, SO2, H2, металлами до N2, солями Cr2+ — до NH3 в нейтральной среде и до NH2OH в кислой. Окисляется, напр. хроматами и перманганатами, до HNO3. С солями мн. металлов образует нитрозокомплексы, напр. нитропруссид Na2[Fe(NO) (CN)5]- важный аналит. реагент. Образование комплексного соед. бурого цвета при взаимодействии NO с FeSO4 в растворе-качественная реакция на NO:
2NO, составляют (в %): 0,61 (2000 °C), 4,48 (3200 °C), 10,00 (4200 °C) С водой, разб. растворами кислот и щелочей не взаимод. При обычных условиях быстро окисляется до NO2, с повышением температуры скорость реакции уменьшается. Это обусловлено тем, что с O2 взаимод. молекулы димера N2O2, содержание которого с повышением температуры уменьшается. Присоединяет галогены с образованием нитрозилгалогени-дов NOHal. С H2SO4 в присутствии воздуха дает нитрозилсер-ную кислоту (NO)HSO4. Восстанавливается углеродом, фосфором, серой, SO2, H2, металлами до N2, солями Cr2+ — до NH3 в нейтральной среде и до NH2OH в кислой. Окисляется, напр. хроматами и перманганатами, до HNO3. С солями мн. металлов образует нитрозокомплексы, напр. нитропруссид Na2[Fe(NO) (CN)5]- важный аналит. реагент. Образование комплексного соед. бурого цвета при взаимодействии NO с FeSO4 в растворе-качественная реакция на NO:
[Fe(H20)6]S04 + NO [Fe(H2O)5NO]SO4 + H2O
[Fe(H2O)5NO]SO4 + H2O
При нагр. раствора идет обратная реакция, и окраска исчезает. При действии NO на губчатое железо при высоком давлении образуется тетранитрозил Fe(NO)4. Известны нитрозилы Ru и Cr.
Монооксид получают каталитич. окислением NH3 как промежут. продукт в производстве азотной кислоты. Перспективен плазмохим. синтез. В лаб. NO получают взаимод. NaNO2 с H2SO4. В атмосфере он образуется при грозовых разрядах. Монооксид применяют также для получения NH2OH.
Сесквиоксид N2O3 (диазота триоксид) ниже −101 °C существует как индивидуальное соединение. При более высоких температурах находится в равновесии с продуктами диссоциации NO и NO-,. Молекула плоская (длины связей в нм).
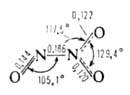
Для N2O3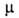 6,77∙10−30 Кл∙м. Раств. в кислотах и эфире. С водой дает HNO2. Образуется из NO и NO2 при охлаждении, по реакции HN3 с As2O3, а также при пропускании электрич. искры через жидкий воздух.
6,77∙10−30 Кл∙м. Раств. в кислотах и эфире. С водой дает HNO2. Образуется из NO и NO2 при охлаждении, по реакции HN3 с As2O3, а также при пропускании электрич. искры через жидкий воздух.
Диоксид NO2 парамагнитен; длина связи N—О 0,119 нм, угол О—N—О 134°; μ 0,87∙10−30 Кл∙м. При отщеплении электрона (энергия ионизации ~ 942 кДж/моль) образуется нитроний-ион NO2 , при присоединении (сродство к электрону −228 кДж/моль)-нитрит-ион NO2.
В обычных условиях NO 2 существует в равновесии с ди-мером-тетраоксидом диазота N2O4 (ΔH° димеризации −57,3 кДж/моль). При нормальном давлении и 4047
в такой смеси содержится 31% NO2, при 100 °C-88% NO2, выше 140 °C N2O4 целиком переходит в NO2. Жидкая смесь состоит в осн. из N2O4, а твердое вещество — чистый димер. Молекула димера диамагнитна, имеет плоскую структуру. Диоксид взаимод. с водой и растворами щелочей:
2NO2 + H2O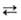 HNO3 + HNO2, 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
HNO3 + HNO2, 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
С соляной кислотой образует NOC1, с серной — (NO)HSO4, с F2-нитрил фторид NO2F. В смеси с CS2 взрывается. Восстанавливается водородом в присутствии Pt или Ni до NH3. Многие вещества (С, S, Р, орг. соед.) сгорают в NO2, так как NO2 и N2O4-сильные окислители. Поскольку в жидком N2O4 существует равновесие: N2O4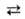 NO+ -I- NO3, нeкоторые металлы (напр., Zn, Cu), реагируя с жидким N2O4, образуют безводные нитраты:
NO+ -I- NO3, нeкоторые металлы (напр., Zn, Cu), реагируя с жидким N2O4, образуют безводные нитраты:
Zn + 2N2O4 → Zn(NO3)2 + 2NO
Растворы N2O4 в безводной HNO3 — более сильные окислители, чем чистая HNO3.
Диоксид-промежут. продукт в производстве HNO3. В лаб. NO2 получают разложением безводного Pb(NO3)2 или взаимод. Cu с конц. азотной кислотой. Диоксид и N2O4-окислители в жидком ракетном топливе, смесевых ВВ, при очистке нефтепродуктов от сераорг. соед., катализаторы окисления орг. соед. (напр., бензола до фенола, метана до формальдегида).
Молекула газообразного оксида азота (V) N2O5 (пентаоксид диазота) имеет неплоскую структуру (длины связей в нм):
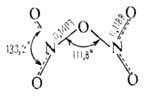
Кристаллич. _ N2O5-ионное соед. (NO2)+(NO3)−. При комнатной температуре самопроизвольно разлагается на NO2 и O2, быстрое нагревание приводит к взрыву. Раств. в CHCl3. С водой образует HNO3. В лаборатории N2O5 получают взаимод. HNO3 с P2O5, жидкого NO2 или N2O3 с озонированным кислородом.
А. о. физиологически активны. Так, N2O — средство для наркоза, в высоких концентрациях вызывает удушье. Другие А. о. сильно ядовиты: NO действует на центральную нервную систему, в больших концентрациях превращает оксигемо-глобин в метгемоглобин; NO2 и N2O4 разрушающе действуют на легкие, в тяжелых случаях вызывают отек, понижают кровяное давление. При длительной работе в атмосфере, содержащей эти оксиды, развиваются разл. хронич. заболевания; ПДК NO2 9 мг/м3, остальных А. о.-5 мг/м3 (в пересчете на NO2).
Лит. см. при ст. азот.
Н. М. Жаворонков, И. К. Малина
Значения в других словарях
- АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) — сесквиоксид N2O3 (синяя жидкость) — диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4) — оксид N2O5 (бесцветные кристаллы). Большой энциклопедический словарь
