Белоусова — Жаботинского реакция
БЕЛОУСОВА — ЖАБОТИНСКОГО РЕАКЦИЯ
протекающее в автоколебат. режиме каталитич. окисление разл. восстановителей бромноватой кислотой HBrO3. При этом наблюдаются колебания концентраций окисленной и восстановленной форм катализатора и некоторых промежут. продуктов. Реакция идет в кислом водном растворе; в качестве катализаторов используют ионы металлов переменной валентности, напр. Ce или Mn, в качестве восстановителей — малоновую кислоту, ацетилацетон и др. Б.-Ж. р. — наиб. изученная гомогенная колебательная реакция, открытие которой стимулировало резкий рост исследований хим. колебаний и привело к созданию новой области хим. кинетики.
Упрощенная схема Б.-Ж. р. включает неск. процессов: 1. Разветвленная цепная реакция окислителя с автокатализатором HBrO2; в результате обеспечивается самоускоряющееся окисление катализатора Мn+ :
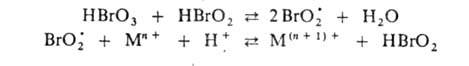
2. Ингибирование окисления в результате быстрой реакции, обрывающей разветвленную цепь:
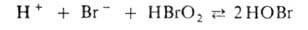
3. Бромирование восстановителя, напр.:
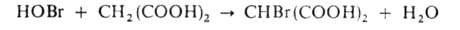
4. Восстановление окисленной формы катализатора М(п + 1)+ и одновременное образование ингибитора — Br− :
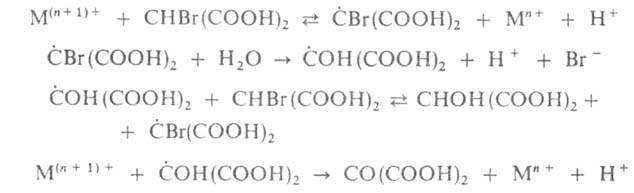
Т. обр. механизм реакции можно изобразить мнемонич. схемой (рис. 1), где автокатализатор HBrO2 обеспечивает непосредственную положит. обратную связь (отмечена знаком +), а ингибитор замыкает петлю отрицат. обратной связи ( — ). Колебат. цикл можно качественно описать след. образом. Когда концентрация М(п+1)+ в системе достаточно велика, скорость образования Br− и его концентрация в растворе также высоки. В результате цепная реакция окисления Мn+ заторможена и концентрация М(п+1)+ падает, стремясь к своему пороговому значению, при достижении которого концентрация Br− резко падает, а концентрация HBrO2 возрастает. Разветвленная цепная реакция ускоряется и концентрация М(п+1)+ начинает расти, стремясь к верх. порогу, при достижении которого концентрация Br− снова резко возрастает, обрывая разветвленную цепь, и цикл повторяется. Колебания концентраций окисленной и восстановленной форм катализатора сопровождаются колебаниями окраски раствора от бесцветной к желтой, если катализатор — ионы церия, или от голубой к красной в случае фенантролинового комплекса железа [Fe(phen)3].
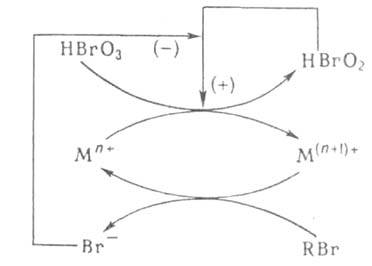
Рис. 1. Схема реакции Белоусова — Жаботинского (RBr-бромпроизводное восстановителя).
Б.-Ж. р. демонстрирует большое число разл. колебат. режимов, которые зависят от температуры, кислотности и концентрации исходных реагентов. Период колебаний может изменяться от десятых долей секунды до десятков минут. Наблюдаются простые периодич. колебания разл. формы, сложные колебания с неск. максимумами в одном периоде, многочастотные и стохастич. колебания (см. рис. 2). При проведении Б.-Ж. р. в закрытой системе можно наблюдать до неск. тысяч циклов; в проточном реакторе колебания поддерживаются сколь угодно долго. В неперемешиваемом растворе, где исключена конвекция, наблюдаются бегущие концентрац. волны, образующие самоподдерживающиеся динамич. структуры (рис. 3).
Реакция открыта Б. П. Белоусовым в 1951, подробно изучалась А. М. Жаботинским в 1964.
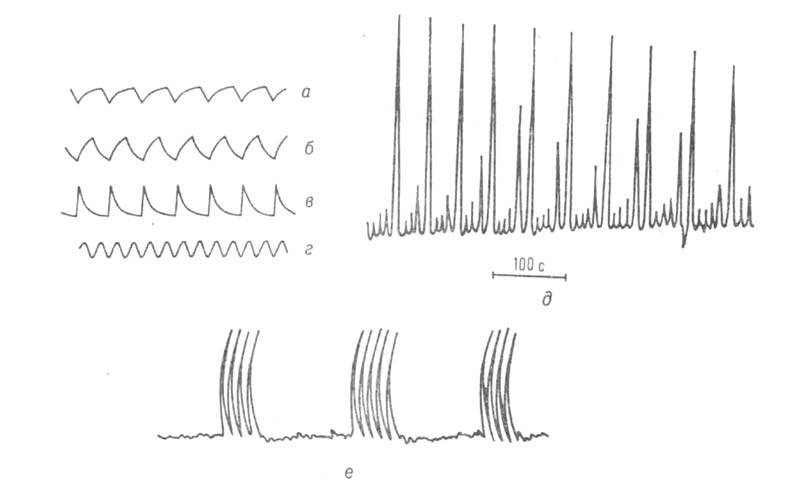
Рис. 2. Разл. типы колебаний концентрации Ce4+ в реакторе идеального перемешивания: а — в — пилообразные колебания с разл. соотношением длительности переднего и заднего фронта; г — синусоидальные колебания; д-хаотич. колебания; е-нестационарные сложно-периодические колебания.
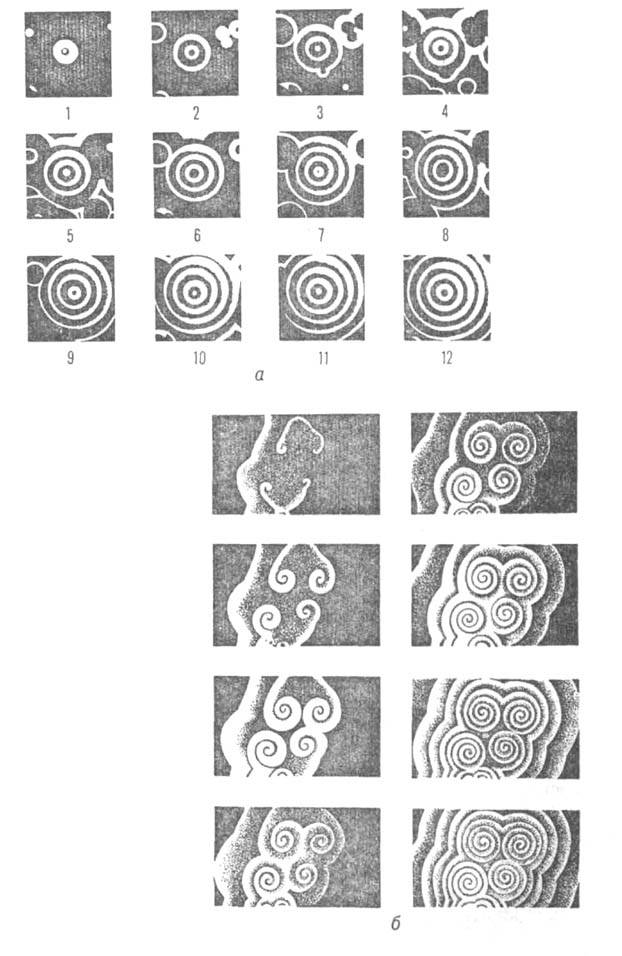
Рис. 3. Динамич. структуры, образованные бегущими концентрац. волнами в тонком слое неперемешнваемого раствора (катализатор [Fe(phen)3]; интервал между кадрами 15с; скорость волн 0,01 см/с): а — концентрич. волны от точечного источника — ведущего центра; длина волны
0,01 см/с): а — концентрич. волны от точечного источника — ведущего центра; длина волны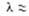 0,55 см; б — спиральные волны;
0,55 см; б — спиральные волны; 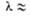 0,15 см.
0,15 см.
Лит.: Жаботинский А. М., Концентрационные автоколебания, М., 1974: Полак Л. С, Михайлов А. С.. Самоорганизация в неравновесных физико-химических системах, М., 1983; Oscillations and traveling waves in chemical systems, N.7Y., 1985.
