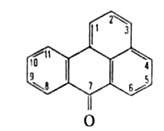
бензантрон
БЕНЗАНТРОН (бензо[de]антрацен-7-он, мезобензантрон)
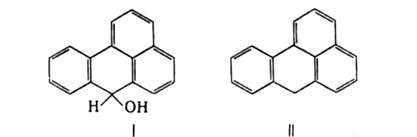
мол. м. 230,20; желтые кристаллы; т. пл. 170–171 °C (с возгонкой); μ 11,62∙10−30 Кл∙м (бензол; 25 °C); раств. в спирте, хлорбензоле, уксусной кислоте, не раств. в воде. В УФ-спектре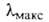 при 230 нм (lgε4,52), 253 нм (lgε 4,30), 282 нм (lgε 3,90), 306 нм (lgε 3,90), 395 нм (lgε4,01). Б. — слабое основание; в конц. H2SO4 присоединяет протон с образованием раствора с красной флуоресценцией, что используется для качеств. определения Б. В апротонных растворителях образует окрашенные комплексы с Cl3ССООН, IC1, с хлоридами Fe(III), Sn(IV), Zn(II) и др.; связь в комплексах осуществляется по кислороду карбонильной группы. Окисляется хромовой кислотой в среде CH3COOH или разб. H2SO4 до антрахинон-1-карбоновой кислоты, восстанавливается щелочным раствором Na2S2O4 до дигидробензантрона (формула I), Zn-пылью — до бензантрена (II).
при 230 нм (lgε4,52), 253 нм (lgε 4,30), 282 нм (lgε 3,90), 306 нм (lgε 3,90), 395 нм (lgε4,01). Б. — слабое основание; в конц. H2SO4 присоединяет протон с образованием раствора с красной флуоресценцией, что используется для качеств. определения Б. В апротонных растворителях образует окрашенные комплексы с Cl3ССООН, IC1, с хлоридами Fe(III), Sn(IV), Zn(II) и др.; связь в комплексах осуществляется по кислороду карбонильной группы. Окисляется хромовой кислотой в среде CH3COOH или разб. H2SO4 до антрахинон-1-карбоновой кислоты, восстанавливается щелочным раствором Na2S2O4 до дигидробензантрона (формула I), Zn-пылью — до бензантрена (II).
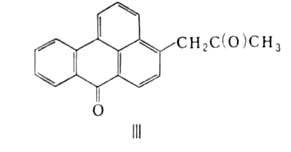
Электроф. реагенты замещают атомы Н в положениях 3 и 9. Так, бромированием суспензии Б. в смеси CH3COOH и HCl при 70 °C получают 3-бромбензантрон (т. пл. 173 °C; выход 96%), а в конц. H2SO4 или в хлорсульфоновой кислоте при 0–40 °C (кат. — I2)-3,9-дибромбензантрон (т. пл. 255–256 °C; выход 98%). Атомы брома в этих соединениях очень подвижны, что используют в производстве кубовых красителей. Б. сульфируется конц. H2SO4 до бензантрон-9-сульфокислоты, хлорсульфоновой кислотой в среде о-дихлорбензола — до бензантрон-3-сульфокислоты, олеумом-до бензантрон-3,9-дисульфокислоты, нитруется 87%-ной HNO3 в нитробензоле при 40–50 °C до 3-нитропроизводного. Нуклеоф. реагенты замещают атом Н в положениях 2 и 4. Так, при прямом аминировании образуется 4-аминобензантрон, при взаимодействии с анилином-4-фениламинобензантрон. При сплавлении со щелочью в присутствии безводного CH3COONa при 225 °C Б. конденсируется до виолантрона — важного красителя для хлопка (см. полициклические кубовые красители). В присут. KOH реагирует с соединениями, имеющими подвижный атом Н, напр. с ацетоном получают кетон формулы III. У Б. слабо выражены свойства, характерные для кетонов, т. е. он не реагирует с NaHSO3, а оксим образует с трудом (выход 30%) при кипячении в пиридине с гидроксиламином в течение 20 ч.
В промышленности Б. получают конденсацией антрахинона с глицерином в конц. H2SO4 при 110–115 °C в присутствии восстановителя (CuSO4 + Zn); выход 89%. Лаб. синтез: постепенное нагревание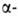 бензоилнафталина (кат. — AlCl3) до 150 °C; выход 76%. Б. — исходное соединение в производстве важных кубовых красителей (т. наз. группы бензантрона). Для Б. ниж. КПВ 20 г/м3. Вызывает дерматиты, экземы; ЛД50 603 мг/кг (белые мыши, внутрибрюшинно); ПДК в водоемах 0,05 мг/л.
бензоилнафталина (кат. — AlCl3) до 150 °C; выход 76%. Б. — исходное соединение в производстве важных кубовых красителей (т. наз. группы бензантрона). Для Б. ниж. КПВ 20 г/м3. Вызывает дерматиты, экземы; ЛД50 603 мг/кг (белые мыши, внутрибрюшинно); ПДК в водоемах 0,05 мг/л.
Лит.: КларЭ., Полициклические углеводороды, т. 2, М., 1971, с. 373; Kirk-Othmer encyclopedia, 3 ed, v. 2, N.Y., 1978, p. 742.
Н. Н. Артамонова
