бензимидазол
БЕНЗИМИДАЗОЛ
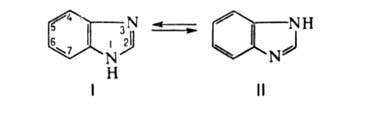
мол. м. 118; бесцветные кристаллы, т. пл. 172 °C; μ 13,42∙10−30 Кл∙м (25 °C, диоксан); раств. в воде, спиртах, разб. кислотах и щелочах, тру дно — в неполярных растворителях. Амфотерен: pKапри 25 °C в воде 5,53 и 13,2. Молекулы ассоциированы благодаря водородной связи —NH...NH=. Положения 4 и 7, а также 5 и 6 равноценны вследствие равновесия между таутомерами I и II:
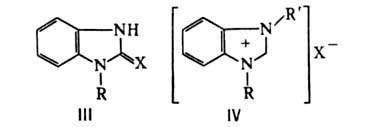
С ионами некоторых металлов (Ag, Co, Cu и др.) Б. образует в аммиачном растворе соли. Б. устойчив к действию окислителей, но CrO3 в 80%-ной H2SO4 при 80 °C окисляет его до имидазол-4,5-дикарбоновой кислоты. Сплавление с S превращает Б. в бензимидазол-2-тион, 1-алкилбензимидазолы — в его 1-алкилзамещенные (формула III, X = S, R = А1К). Б. алкилируется алкилгалогенидами и диалкилсульфатами в присутствии щелочей в положение 1. При алкилировании N-алкилбензимидазолов образуются соли 1,3-диалкилбензимидазолия (формула IV). Арилирование Б. в положение 1 с помощью галогенаренов протекает обычно в жестких условиях. Действием ацилхлоридов и ангидридов кислот получают N-ацилпроизводные. Б. нитруется смесью HNO3 и H2SO4 в положение 5. При сульфировании образуется 5(6)-сульфокислота. Нуклеоф. замещение протекает в положении 2 лишь с N-производными Б. При нагревании с NaNH2 в диметиланилине образуются 2-аминопроизводные Б., при сплавлении с КОН-бензимидазолоны (формула III, X = О). Металлирование (напр., фенилнатрием) идет в положение 2.
При взаимодействии o-фенилендиамина с HCOOH образуются Б., с RCOOH в присутствии HCl-2-алкилбензимидазолы, с ArCHO и ацетатом Cu(1)-2-арилбензимидазолы (реакция Вайденхагена). Сам Б. не находит пром. применения, однако его производные являются лек. средствами (напр., дибазол), фунгицидами (напр., беномил) и др. См. также полибензимидазолы.
Лит.: ШипперЭ., ДэйА., в кн.: Гетероциклические соединения, пер. с англ., т. 5, М., 1961, с. 161–241; Пожарский А.Ф. [и др.], "Успехи химии", 1966, т. 35, № 2, с. 261–302; Preston P.M., "Chem. Revs.", 1974, v. 74, № 3, p. 279–314; его же, The chemistry of heterocydic compounds, v. 40 (Ц Edinburgh, 1981, p. 1–285.
А. М. Симонов
