бензотрихлорид
БЕНЗОТРИХЛОРИД [(трихлорметил)бензол, α,α,α-трихлортолуол] C6H5CCl3
мол. м. 195,48; бесцв. маслообраз-ная жидкость с раздражающим запахом; т. пл. −4,8 °C, т. кип. 220,6 °C; плотн. 1,372 г/см3 (20 °C); nD20 1,5580; η 2,55 мПа∙с (17 °C); давление пара (кПа): 0,13 (45,8 °C), 5,33 (119,8 °C), 53,32 (189,2 °C); 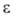 6,35 (20,6 °C); не раств. в воде, хорошо раств. в спирте, эфире, бензоле. Атомы С1 в молекуле достаточно реакционноспособны. При взаимодействии с SbF3 в присутствии SbCl5 Б. легко превращ. в бензотрифторид (реакция Свартса). Водой гидролизуется в бензойную кислоту при температурах до 150 °C (медленно на свету при ~20 °C; кислоты и щелочи ускоряют гидролиз). Реагирует с бензойной кислотой в присутствии FeCl3, образуя бензоилхлорид, с диметиланилином дает краситель малахитовый зеленый. При нагр. Б. с Cu при 100 °C и при гидрировании в спиртовой среде (кат. — Pd) образуется толантетрахлорид C6H5CCl2CCl2C6H5, с Zn в среде эфира — толандихлорид C6H5СС1—СС1C6H5. Хлорирование в присутствии FeCl3 приводит гл. обр. к м-хлорбензотрихлориду, нитрование — к м-нитробензотрихлориду (выход 65%).
6,35 (20,6 °C); не раств. в воде, хорошо раств. в спирте, эфире, бензоле. Атомы С1 в молекуле достаточно реакционноспособны. При взаимодействии с SbF3 в присутствии SbCl5 Б. легко превращ. в бензотрифторид (реакция Свартса). Водой гидролизуется в бензойную кислоту при температурах до 150 °C (медленно на свету при ~20 °C; кислоты и щелочи ускоряют гидролиз). Реагирует с бензойной кислотой в присутствии FeCl3, образуя бензоилхлорид, с диметиланилином дает краситель малахитовый зеленый. При нагр. Б. с Cu при 100 °C и при гидрировании в спиртовой среде (кат. — Pd) образуется толантетрахлорид C6H5CCl2CCl2C6H5, с Zn в среде эфира — толандихлорид C6H5СС1—СС1C6H5. Хлорирование в присутствии FeCl3 приводит гл. обр. к м-хлорбензотрихлориду, нитрование — к м-нитробензотрихлориду (выход 65%).
В промышленности Б. получают жидкофазным хлорированием толуола в присутствии 2,2'-азо-бис-изобутиронитрила. Содержание Fe3+ в толуоле и хлоре не должно превышать 0,00002%. Процесс ведут при 85–100 °C в каскаде эмалиров. реакторов до достижения плотности реакц. массы 1,405–1,410 г/м3; после удаления из нее азотом при 60–70 °C кислых газов Б. выделяют ректификацией, выход 90–95%. Лаб. методы получения: хлорирование толуола в присутствии PCl5, взаимод. бензоилхлорида с PCl5 или толуола с SOCl2.
Применяют Б. для получения бензоилхлорида, бензотрифторида, бензойной кислоты, красителей и др.
Б. — невзрывоопасный горючий продукт; т. всп. 91 °C, т. самовоспл. 433 °C, температурные пределы воспламенения 84–92 °C. Раздражает слизистые оболочки и кожу; ПДК паров 0,2 МГ/М3.
Г. В. Моцарев
