бериллия фторид
БЕРИЛЛИЯ ФТОРИД BeF2
кристаллич. или аморфное вещество. До 220 °C устойчива модификация с гексаген, решеткой типа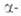 кварца (а = 0,4750 нм, с = 0,5186 нм, z = 3); плотн. 1,97 г/см3; C0p 51,84 Дж/(моль∙К);
кварца (а = 0,4750 нм, с = 0,5186 нм, z = 3); плотн. 1,97 г/см3; C0p 51,84 Дж/(моль∙К); 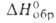 −1027 кДж/моль,
−1027 кДж/моль, 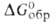 −979,9 кДж/моль; 5o298 53,3
−979,9 кДж/моль; 5o298 53,3
Дж/(моль∙К). Эта модификация при нагр. переходит в гексагональную типа β-кварца с т. пл. 550 °C и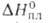 4,77 кДж/моль. Известна также тетрагон. модификация (типа α-кристобалита), которая при 130 °C переходит в кубическую типа
4,77 кДж/моль. Известна также тетрагон. модификация (типа α-кристобалита), которая при 130 °C переходит в кубическую типа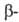 кристобалита с т. пл. 800 °C. Т. кип. 1175СС,
кристобалита с т. пл. 800 °C. Т. кип. 1175СС, 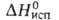 200 кДж/моль. Б. ф. гигроскопичен, раств. в воде (846 г/л при 25 °C), не раств. в этаноле. Гидролизуется растворами щелочей и водой при нагревании, взаимод. с H2SO4. Получают BeF2 разложением (NH4)2BeF4 при 800–1100 °C, значительно реже — взаимод. ВеО с газообразным HF. Магниетермич. восстановлением BeF2 получают металлич. Be. Б.ф. — компонент фторобериллатных стекол и солевой смеси ядерных реакторов на расплавл. солях. Б.ф. токсичен; ПДК 0,001 мг/м3.
200 кДж/моль. Б. ф. гигроскопичен, раств. в воде (846 г/л при 25 °C), не раств. в этаноле. Гидролизуется растворами щелочей и водой при нагревании, взаимод. с H2SO4. Получают BeF2 разложением (NH4)2BeF4 при 800–1100 °C, значительно реже — взаимод. ВеО с газообразным HF. Магниетермич. восстановлением BeF2 получают металлич. Be. Б.ф. — компонент фторобериллатных стекол и солевой смеси ядерных реакторов на расплавл. солях. Б.ф. токсичен; ПДК 0,001 мг/м3.
С фторидами щелочных металлов и аммония BeF2 образует фторобериллаты. Тетрафторобериллат аммония (NH4)2BeF4-кристаллы; при нагр. разлагается последовательно до NH4BeF3 и BeF2; C0p 211 Дж/(моль∙К); 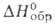 −1990 кДж/моль,
−1990 кДж/моль, 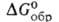 −1728 кДж/моль; S0298 250 Дж/(моль∙К); раств. в йоде (32,2% по массе при 25 °C) и растворах NH4F. Получают: взаимод. ВеО с водными растворами HF или NH4HF2 с послед, добавлением NH3 и выпариванием; реакцией ВеО или Ве(OH)2 с безводным NH4HF2 при 100–200 °C.
−1728 кДж/моль; S0298 250 Дж/(моль∙К); раств. в йоде (32,2% по массе при 25 °C) и растворах NH4F. Получают: взаимод. ВеО с водными растворами HF или NH4HF2 с послед, добавлением NH3 и выпариванием; реакцией ВеО или Ве(OH)2 с безводным NH4HF2 при 100–200 °C.
Тетрафторобеоиллат лития Li2BeF4 — кристаллы; т. пл. 459,1 °C; 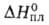 43,9 кДж/моль; C0 135 Дж/(моль∙К);
43,9 кДж/моль; C0 135 Дж/(моль∙К); 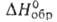 −2272 кДж/моль,
−2272 кДж/моль, 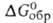 -2170 кДж/моль; S0298 130 Дж/(моль∙К); умеренно раств. в воде; растворяет UF4, ThF4, ZrF4 и др. фториды. Получают сплавлением BeF2 с LiF. Используют как компонент солевой смеси ядерных реакторов на расплавл. солях.
-2170 кДж/моль; S0298 130 Дж/(моль∙К); умеренно раств. в воде; растворяет UF4, ThF4, ZrF4 и др. фториды. Получают сплавлением BeF2 с LiF. Используют как компонент солевой смеси ядерных реакторов на расплавл. солях.
Тетрафторобериллат натрия Na2BeF4 — кристаллы; т. пл. ок. 590 °C; раств. в воде (1,37% по массе при 20 °C). Получают спеканием бериллиевых концентратов с Na2SiF6 и Na,CO3 при 750–800 °C или сплавлением BeF2 с NaF; в лаб. — взаимод. Ве(OH)2 с фтористоводородной кислотой и Na2CO3. Промежут. продукт в производстве Ве(OH)2 и др. соединений Be.
Лит. см. при ст. бериллий.
Э. Г. Раков
