бимолекулярные реакции
БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ
хим. реакции, в элементарном акте которых превращению подвергаются две частицы (молекулы, радикалы или ионы). В результате могут возникать одна, две или (в редких случаях) три и более частиц продукта:
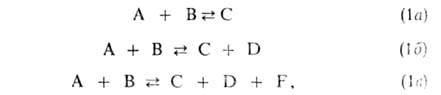
где А и В — молекулы реагентов, С, D и F — молекулы продуктов. Наиб. обширный класс Б.р. — реакции типа (16). бимолекулярные как в прямом, так и в обратном направлениях. Их кинетика описывается уравнением:
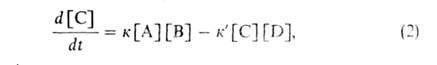
где к и к'-константы скорости реакции соотв. в прямом и обратном направлениях, [А], [В] и [С], [D] — концентрации реагентов и продуктов.
Реакции в газах. Поскольку в газах время между последовательными столкновениями молекул (10−10 с при нормальных условиях) много больше времени столкновение (10−12 — 10−13 с), влияние среды (окружения) проявляется лишь в соударениях реагирующих молекул с молекулами окружения до или после столкновения реагирующих молекул друг с другом, но не за время одного столкновения. Поэтому элементарный акт реакции можно рассматривать как результат изолированного парного столкновения. Tакие столкновения могут приводить к изменению числа частиц с энергией, превышающей энергию активации реакции Е, и нарушению максвелл-больцмановского распределения частиц по энергиям их относит. движения и внутр. степеням свободы. В зависимости от соотношения скоростей реакции и процессов релаксации, восстанавливающих это распределение, различают равновесные и неравновесные Б. р.
Равновесные реакции протекают сравнительно медленно, максвелл-больцмановское распределение практически сохраняется, и скорость реакции w м. б. рассчитана в рамках активированного комплекса теории:
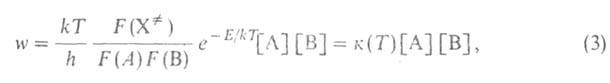
где k и h-постоянные Больцмана и Планка соотв., Т — абс. температура, F(A), F(B)и F(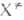 )-статистич. суммы исходных реагентов А и В и активированных комплексов
)-статистич. суммы исходных реагентов А и В и активированных комплексов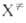 , кислот. наз. макроскопич. константа скорости реакции. Поскольку
, кислот. наз. макроскопич. константа скорости реакции. Поскольку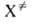 рассматривается как обычная молекула, в которой одна степень свободы колебат. движения заменена степенью свободы постулат. движения вдоль координаты реакции, статистич. сумма F(
рассматривается как обычная молекула, в которой одна степень свободы колебат. движения заменена степенью свободы постулат. движения вдоль координаты реакции, статистич. сумма F(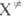 ) вычисляется как статистич. сумма обычной молекулы без одной степени свободы колебат. движения. Для модели столкновения молекул как жестких шаров с массами mA и mB и радиусами rА и rB отношение статистич. сумм в (3) равно газокинетич. числу столкновений:
) вычисляется как статистич. сумма обычной молекулы без одной степени свободы колебат. движения. Для модели столкновения молекул как жестких шаров с массами mA и mB и радиусами rА и rB отношение статистич. сумм в (3) равно газокинетич. числу столкновений:
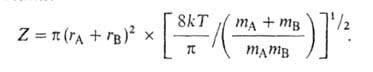
Тогда к(Т)= ZPe−E/kT, где Р — т. наз. стерич. фактор, учитывающий вероятность наиб. благоприятной для реакции взаимной ориентации сталкивающихся молекул. Теория активированного комплекса позволяет вычислить его величину в предположении, что при образовании активированного комплекса происходит замена вращат. степеней свободы колебательными. Отсюда следует, что для многих реакций Р — малая величина (меньше единицы), а их скорость намного меньше значения, рассчитанного на основе газокинетич. теории. Следовательно, стерич. фактор действительно отражает динамич. процессы; в частности, он зависит от вероятности образования предпочтительной для реакции конфигурации активированного комплекса.
Для неравновесных реакций, скорость которых сравнима со скоростями релаксационных процессов, максвелл-больцмановское распределение нарушается сильно и теория активированного комплекса неприменима. Необходимо учитывать распределения частиц не только по энергиям их относит. движения, но и по квантовым состояниям, а также изменение этих распределений. Для этого стехиометрич. уравнение (1б) записывают в микроскопич. форме с учетом фиксированных квантовых состояний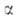 и
и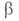 реагирующих частиц А и В и образующихся из них квантовых состояний
реагирующих частиц А и В и образующихся из них квантовых состояний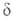 и
и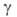 частиц продуктов С и D соотв.:
частиц продуктов С и D соотв.:
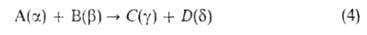
Характеристика такого парного столкновения — т. наз. интегральное сечение реакции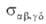 . По физ. смыслу эта величина соответствует площади мишени, центр которой совпадает с центром масс одной из реагирующих молекул, если при попадании в эту мишень второй молекулы происходит процесс (4). Произведение скорости относит. движения сталкивающихся частиц на интегральное сечение реакции равно потоку молекул, которые в случае "попадания" в мишень прореагировали или изменили свое квантовое состояние, т. е. равно скорости процесса (4). Теоретич. расчет
. По физ. смыслу эта величина соответствует площади мишени, центр которой совпадает с центром масс одной из реагирующих молекул, если при попадании в эту мишень второй молекулы происходит процесс (4). Произведение скорости относит. движения сталкивающихся частиц на интегральное сечение реакции равно потоку молекул, которые в случае "попадания" в мишень прореагировали или изменили свое квантовое состояние, т. е. равно скорости процесса (4). Теоретич. расчет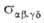 или его эксперим. определение — осн. задача динамики элементарного акта реакции.
или его эксперим. определение — осн. задача динамики элементарного акта реакции.
Скорость процесса (4) выражают через сечение реакции и функцию распределения f(и) частиц по скоростям их относит. движения:
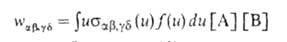
Если бимолекулярный процесс (4) не нарушает термически равновесного распределения частиц по "скоростям, описываемого максвелловской функцией fo(и, Т), он характеризуется т. наз. микроскопич. константой скорости
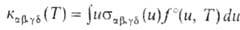 . Если же распределение частиц реагентов остается термически равновесным не только по скоростям их относит. движения, но и по внутр. состояниям и характеризуется больцмановской функцией
. Если же распределение частиц реагентов остается термически равновесным не только по скоростям их относит. движения, но и по внутр. состояниям и характеризуется больцмановской функцией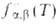 представляет интерес полная концентрация частиц продуктов независимо от их квантового состояния. В этом случае реакция характеризуется макроскопич. константой скорости, которую получают из
представляет интерес полная концентрация частиц продуктов независимо от их квантового состояния. В этом случае реакция характеризуется макроскопич. константой скорости, которую получают из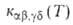 суммированием по конечным состояниям частиц продуктов и усреднением по начальным состояниям частиц реагентов:
суммированием по конечным состояниям частиц продуктов и усреднением по начальным состояниям частиц реагентов:
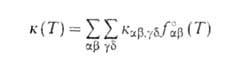
Аналогичным образом м. б. определена любая частично усредненная константа скорости, которая описывает кинетику реакции при разл. степени детализации квантовых состояний частиц реагентов и продуктов.
Таким образом, теория Б. р. связывает кинетич. параметр реакции — константу скорости к (Т)-с сечением реакции, т. е. с динамич. характеристикой парного столкновения молекул. Приближенное значение к (Т) для равновесных реакций может быть также рассчитано в рамках теории активированного комплекса, что позволяет избежать промежут. расчета сечения реакции и микроскопич. констант скорости.
Для очень быстрых процессов, напр. горения, процессов в ударных волнах и плазме, для ряда космохим. реакций, когда в системе полностью отсутствует термич. распределение частиц, понятия микроскопич. и макроскопич. констант скорости реакции теряют смысл и сечение реакции становится ее единственной характеристикой.
Количеств. оценка скорости Б. р. и расчет констант скорости — чрезвычайно сложная задача, требующая знания функций распределения реагирующих частиц и частиц продуктов по внутр. степеням свободы. Информация о столкновениях между отдельными молекулами на предварительно выбранных энергетич. уровнях стала доступной благодаря использованию молекулярных пучков метода. Для экзотермич. реакций очень важно исследование функции распределения молекул продуктов по колебательно-вращательным состояниям. Если это распределение сильно неравновесно, запасенная в молекулах энергия м. б. непосредственно превращена в когерентное электромагн. излучение хим. лазера. Другое практич. применение сведений о кинетике неравновесных Б. р. связано с возможностью избирательного увеличения скорости эндотермич. реакций путем предварительного перевода молекул реагентов в определенные возбужденные состояния.
Е. Е. Никитин
Реакции в жидкостях и твердых телах. Частицы, реагирующие друг с другом в жидкости или в твердом теле, сильно взаимод. с окружением, поэтому функция распределения их по энергии является, как правило, максвелл-больцмановской, а кинетика Б. р. — равновесной. Лимитирующая стадия таких реакций — собственно хим. взаимод. при контакте реагирующих частиц или диффузионное сближение частиц. В последнем случае скорость реакции контролируется диффузией, и энергия активации реакции совпадает с энергией активации диффузии. В твердых телах диффузионное перемещение частиц замедляется настолько, что сближение реакционных центров осуществляется по недиффузионным механизмам: посредством миграции своб. валентности — эстафетной передачей атома Н (в радикальных реакциях), эстафетным переносом протона или электрона, миграцией экситона (в реакциях электронно-возбужденных частиц). Низкая молекулярная подвижность в конденсированной фазе обеспечивает также относительно большое время жизни партнеров-частиц в состоянии контакта и более высокую вероятность реакции по сравнению с соответствующими газофазными реакциями (см. клетки эффект).
Важная особенность Б. р. в жидкостях и твердых телах — сольватация реагентов, которая изменяет реакционную способность и состав реагирующих частиц (напр., соотношение своб. и сольватированных радикалов, ионов и ионных пар, молекул и их ассоциатов и т. д.). Сольватация изменяет скорость, а часто и направление и механизм Б. р., влияет на выход продуктов и является поэтому эффективным способом управления реакцией.
Лит.: Термические бимолекулярные реакции в газах, М., 1976; Энтелис С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе, М.. 1973.
А. Л. Бучаченко
Значения в других словарях
- Бимолекулярные реакции — Химические реакции, в элементарном акте которых участвуют две частицы, например: NOI + NOI →2NO + I2 Б. р. — наиболее распространённый класс химических реакций. Большая советская энциклопедия
- Бимолекулярные реакции — (хим.) — Если едким натром омыляется, напр. уксусноэтиловый эфир, то реакция протекает по уравнению: СН3.СО.ОС2Н5 + NaOH = CH3.CO.ONa + (НО)С2Н5, показывающему, что оба взятые в реакцию тела одновременно претерпевают химическое изменение. Энциклопедический словарь Брокгауза и Ефрона
