бора оксиды
БОРА ОКСИДЫ
Сесквиоксид (или просто оксид) В2O3 — бесцв. стеклообразное или кристаллич. вещество горьковатого вкуса. Диэлектрик. Стеклообразный (плотн. 1,812 г/см3; 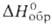 −1254,9 кДж/моль) имеет слоистую структуру с расстоянием между слоями 0,185 нм; атомы В расположены внутри равносторонних треугольников BO3; длина связи В—О 0,145 нм; плавится в интервале 325–450 °C; обладает высокой твердостью (ок. 4 по Моосу); получают нагреванием на воздухе В до 700 °C или обезвоживанием H3BO3 при ~235 °C. Кристаллич. В2O3 получают осторожным отщеплением воды от α-HBO2; при обычных условиях существует модификация с гексагон. решеткой (а — 0,433 нм, с = 0,832 нм, z = 3, пространственная группа Сст21; плотн. 2,46 г/см3), которая при 400 °C и 2200 МПа переходит в моноклинную. Т. пл. 450 °C, т. кип. 2250 °C; C0p 62,76 Дж/(моль∙К);
−1254,9 кДж/моль) имеет слоистую структуру с расстоянием между слоями 0,185 нм; атомы В расположены внутри равносторонних треугольников BO3; длина связи В—О 0,145 нм; плавится в интервале 325–450 °C; обладает высокой твердостью (ок. 4 по Моосу); получают нагреванием на воздухе В до 700 °C или обезвоживанием H3BO3 при ~235 °C. Кристаллич. В2O3 получают осторожным отщеплением воды от α-HBO2; при обычных условиях существует модификация с гексагон. решеткой (а — 0,433 нм, с = 0,832 нм, z = 3, пространственная группа Сст21; плотн. 2,46 г/см3), которая при 400 °C и 2200 МПа переходит в моноклинную. Т. пл. 450 °C, т. кип. 2250 °C; C0p 62,76 Дж/(моль∙К); 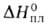 24,56 кДж/моль,
24,56 кДж/моль, 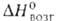 433 кДж/моль (О К),
433 кДж/моль (О К), 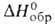 −1273,5 кДж/моль,
−1273,5 кДж/моль, 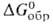 −1178 кДж/моль,
−1178 кДж/моль, 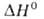 перехода кристаллич. → стеклообразный 18,6кДж/моль; S029853,97 Дж/(моль∙К). Оксид В2O3 термически стоек; не восстанавливается углем даже при 1000 °C. В присут. угля при нагревании с галогенами образует галогениды, с N2 — нитрид, энергично взаимод. с водой, давая H3BO3. Расплавл. В2O3 растворяет оксиды мн. металлов. В2O3 — промежут. продукт в производстве В; он входит в состав спец. стекол, керамики, эмали.
перехода кристаллич. → стеклообразный 18,6кДж/моль; S029853,97 Дж/(моль∙К). Оксид В2O3 термически стоек; не восстанавливается углем даже при 1000 °C. В присут. угля при нагревании с галогенами образует галогениды, с N2 — нитрид, энергично взаимод. с водой, давая H3BO3. Расплавл. В2O3 растворяет оксиды мн. металлов. В2O3 — промежут. продукт в производстве В; он входит в состав спец. стекол, керамики, эмали.
В газовой фазе при высокой температуре существует монооксид ВО; ΔH0обр 9,9 кДж/моль, энергия диссоциации 879 кДж/моль. При нагревании В2O3 с В при 1000 °C в парах обнаружены линейные молекулы диоксида дибора О=В—В=О; прочность связи В—В превышает 418 кДж/моль; 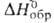 −461,7 кДж/моль; при охлаждении паров диспропорционирует с образованием В2O3 и В, при быстром охлаждении до 300 °C м. б. получен аморфный и весьма реакционноспособный полимерный оксид (В2O2)x. При взаимодействии В с В2O3 под давлением ок. 6000 МПа при 1500 °C образуется кристаллич. гемиоксид В2O со слоистой структурой типа графита;
−461,7 кДж/моль; при охлаждении паров диспропорционирует с образованием В2O3 и В, при быстром охлаждении до 300 °C м. б. получен аморфный и весьма реакционноспособный полимерный оксид (В2O2)x. При взаимодействии В с В2O3 под давлением ок. 6000 МПа при 1500 °C образуется кристаллич. гемиоксид В2O со слоистой структурой типа графита; 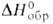 для газа 271,8 кДж/моль. Известны также BO2 (
для газа 271,8 кДж/моль. Известны также BO2 (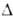 H°обр для газа −324,1 кДж/моль), В6О и др. оксиды В.
H°обр для газа −324,1 кДж/моль), В6О и др. оксиды В.
Лит. см. при статьях бор, борные кислоты.
Г. Н. Кононова
