бора трифторид
БОРА ТРИФТОРИД BF3
бесцветный газ с удушливым запахом, дымящий во влажном воздухе. Молекула плоская, длина связи В—F 0,1295 нм, угол FBF 120°, энергия диссоциации 1920 кДж/моль. Т. пл. −128,36 °C, т. кип. −100,3 °C; плотн. 0,00307 г/см3 (20 °C), твердого — 1,87 г/см3 ( −130 °C); tкрит — 12,3 °C, pкрит 49,8∙105 Па; C0p 50,5 Дж/(моль∙К); ΔH0пл4,62 кДж/моль, ΔH0исп 17,1 кДж/моль, 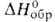 −1119 кДж/моль; S0298 254,3 Дж/(моль∙К); уравнения температурных зависимостей плотности жидкого BF3 и давления пара над жидким BF3: d(кг/м3) = 1699 — 4,45(t+125) (-124,3
−1119 кДж/моль; S0298 254,3 Дж/(моль∙К); уравнения температурных зависимостей плотности жидкого BF3 и давления пара над жидким BF3: d(кг/м3) = 1699 — 4,45(t+125) (-124,3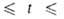 102,4 °C); lg p(Па)= 10,1785- 1174,4/7+ 1,75 lg T — 0,013350Т (145,9
102,4 °C); lg p(Па)= 10,1785- 1174,4/7+ 1,75 lg T — 0,013350Т (145,9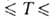 170,3 К).
170,3 К).
Б. т. раств. в воде (332,1 г в 100 г H2O при 0 °C, 772 МПа, с частичным гидролизом), водных растворах HF (с образованием Н [BF4]), многих органических растворителях. Образует неустойчивые выше 20 °C моногидрат (т. пл. 10,18 °C) и дигидрат (т. пл. 6,36 °C).
Б. т. — сильная кислота Льюиса. Образует аддукты со спиртами, эфирами, альдегидами, кетонами, орг. основаниями, неорг. и орг. кислотами. Получают взаимод. В или его соед. с F2, а также по реакциям:
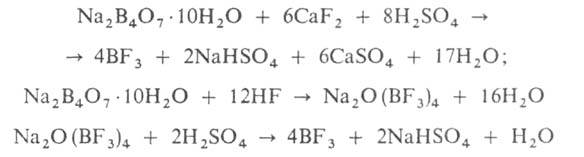
Вместо Na2B4O7 м. б. использован СаВО4. Применяют как катализатор многих орг. реакций, в качестве наполнителя в счетчиках нейтронов. Б. т. токсичен, ПДК 1 мг/м3.
Эфират (C2H5)2O*BF3 — бесцветная жидкость; т. пл. −60,4 °C, т. кип. 125 °C (с разл.); d425 1,125; nD20 1,348; 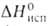 54,39 кДж/моль (298 К), ΔH0обр жидкого −352,8 кДж/моль (298 К). Гидролизуется водой.
54,39 кДж/моль (298 К), ΔH0обр жидкого −352,8 кДж/моль (298 К). Гидролизуется водой.
Анизолят C6H5OCH3*BF3 — бесцветная жидкость; т. пл. 2 °C; d425 1,207. Разлагается ок. 25 °C. Гидролизуется водой; раств. в анизоле. Применяют как рабочее тело при разделении изотопов В.
Лит.: Топчиев А. В., Завгородний С. В., Паушкин Я. М., Фтористый бор и его соединения как катализаторы в органической химии, М., 1956; Greenwood N. N., The chemistry of boron, Oxf., 1975 (Pergamon texts in inorganic chemistry, v. 8).
Э. Г. Раков, С. Г. Катальников
