борные кислоты
БОРНЫЕ КИСЛОТЫ
Ортоборная кислота (борная кислота) H3BO3 — бесцветные кристаллы, решетка слоистая, триклинная (а = Ь = 0,704 нм, с = 0,656 нм, 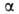 = 101,10°,
= 101,10°, 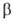 = 92,30°,
= 92,30°, 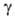 = = 120,00°, z = 4, пространственная группа Pl, расстояния между слоями 0,318 нм); плотн. 1,46 г/см3. При давлении выше 4200 МПа образуется модификация с ромбич. решеткой, выше 5700 МПа — с тетрагональной. При медленном нагревании H3BO3 при 107,5 °C превращается в метаборную кислоту HBO2, при 160 °C — в В2O3. Т. пл. 170,9 °C (с разл.); C0p 81,3 Дж/(моль∙К); ΔH0пл 22,34 кДж/моль, ΔH0исп 98,1 кДж/моль, ΔH0возг 63,97 кДж/моль, ΔH0обр −1094,9 кДж/моль; S0298 88,74 Дж/(моль∙К). Раств. в воде (2,60% по массе при 0 °C, 4,80% при 20 °C, 10,35% при 50 °C, 28,7% при 100 °C), глицерине (19,48% при 25 °C), метаноле (21,0%), этаноле (11,2%), ацетоне (0,65%), жидком NH3, диоксане, пиридине; практически не раств. в эфире.
= = 120,00°, z = 4, пространственная группа Pl, расстояния между слоями 0,318 нм); плотн. 1,46 г/см3. При давлении выше 4200 МПа образуется модификация с ромбич. решеткой, выше 5700 МПа — с тетрагональной. При медленном нагревании H3BO3 при 107,5 °C превращается в метаборную кислоту HBO2, при 160 °C — в В2O3. Т. пл. 170,9 °C (с разл.); C0p 81,3 Дж/(моль∙К); ΔH0пл 22,34 кДж/моль, ΔH0исп 98,1 кДж/моль, ΔH0возг 63,97 кДж/моль, ΔH0обр −1094,9 кДж/моль; S0298 88,74 Дж/(моль∙К). Раств. в воде (2,60% по массе при 0 °C, 4,80% при 20 °C, 10,35% при 50 °C, 28,7% при 100 °C), глицерине (19,48% при 25 °C), метаноле (21,0%), этаноле (11,2%), ацетоне (0,65%), жидком NH3, диоксане, пиридине; практически не раств. в эфире.
Б.к. — слабая кислота; Ka1 = 5,8∙10−10, Ka2 = 4∙10−13, Ka3 = = 4∙10−14. Кислотные свойства в водном растворе обусловлены образованием H+ по реакции: H3BO3 + H2O → [В(OH)4]−+ H+. По мере увеличения концентрации H3BO3 в растворе образуются полиборатные анионы, напр. [В3O3(OH)4]−, [В4O5(OH)4]2−. Со спиртами и полиолами H3BO3 в присутствии H2SO4 образует эфиры, в присутствии щелочей — комплексные соединения.
В природе H3BO3 встречается в виде минерала сассолина, а также в термальных водах и прир. рассолах, из которых ее экстрагируют спиртами или смесью полиолов либо сорбируют неорг. и орг. сорбентами. При получении H3BO3 из прир. боратов их разлагают H2SO4 при 100 °C и отфильтровывают нерастворимый остаток; фильтрат охлаждают до 15 °C, выпавшие при этом кристаллы H3BO3 отделяют на центрифугах и сушат при температуре не выше 100 °C. Используют для получения спец. стекла, эмалей, цементов, флюсов, моющих и косметич. средств, огнезащитных составов, как дезинфицирующее и консервирующее средство, ингибитор коррозии, реагент в фотографии, в качестве микроудобрения, в производстве др. борсодержащих соединений. Объемы производства H3BO3 в основных странах-производителях в 1981: в США — 300, Турции — 150 тыс. т/год. ПДК в сточных водах санитарно — бытового назначения 0,5 мг/л (в пересчете на В).
Б.к. впервые была получена из буры в 1702 В. Гомбергом.
Мета борная кислота HBO2 — бесцветные кристаллы. Существует в трех модификациях: 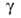 (наиб. устойчива) с кубич. решеткой (а = 0,887 нм, z = 24), т. пл. 236 °C (с разл.), плотн. 2,486 г/см3, ΔH0обр −804,6 кДж/моль;
(наиб. устойчива) с кубич. решеткой (а = 0,887 нм, z = 24), т. пл. 236 °C (с разл.), плотн. 2,486 г/см3, ΔH0обр −804,6 кДж/моль; 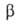 с моноклинной решеткой, т. пл. 200,9 °C (с разл.), плотн. 2,045 г/см3, ΔH0обр −794 кДж/моль; α с ромбич. решеткой, т. пл. 176 °C (с разл.), плотн. 1,784 г/см3, ΔH0обр −789,3 кДж/моль. Температура перехода
с моноклинной решеткой, т. пл. 200,9 °C (с разл.), плотн. 2,045 г/см3, ΔH0обр −794 кДж/моль; α с ромбич. решеткой, т. пл. 176 °C (с разл.), плотн. 1,784 г/см3, ΔH0обр −789,3 кДж/моль. Температура перехода 160 °C. С водой HBO2 легко образует H3BO3.
160 °C. С водой HBO2 легко образует H3BO3.
В водных растворах предполагается существование полиборных кислот общей формулы H3m_2nВmO3m_n.
Лит.: ТкачевК. В., Плышевский Ю. С, Технология неорганических соединений бора, Л, 1983.
Г. Н. Кононова
Значения в других словарях
- БОРНЫЕ КИСЛОТЫ — БОРНЫЕ КИСЛОТЫ: метаборная HBO2 — ортоборная, или просто борная, H3BO3 и полиборные общей формулы nB2O3. m H2O (напр., тетраборная H2B4O7). H3BO3 — слабая трехосновная кислота; в безводном виде бесцветные кристаллы. Большой энциклопедический словарь
