борорганические соединения
БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат атом В, связанный с орг. остатком. Включают: органобораны RnBX3-n(n = 1–3); нейтральные комплексы RnX3-nB*L (и = 1–3); органобораты M[RnBX4_n] (n = 1–4); борониевые соли [R(X)BL2]Y, где Х-Н, Hal, OH, OR', SeR', NH2, NR2, NHNHR', SO4 и т. д., М — катион металла, NH4 или др., L — эфир, амин, сульфид, фосфин и др., Y — анион. К Б. с. также относят соед., содержащие В в цикле (борацикланы), внутрикомплексные соед. и органокарбораны (см. карбораны). Синтезированы диборные [напр., R2B—BR2, R2BNHNHBR2, C6H4(BR2)2] и полиборные соединения. Во всех этих веществах координационное число бора 3 или 4. Наиб. изучены алкил-, циклоалкил-, арил-, алкенил- и аллилбораны, а также борацикланы.
В органоборанах атом В и три связанных с ним атома лежат в одной плоскости, а вакантная 2р-орбиталь перпендикулярна к ней; углы RBX близки к 120° (исключение-1-бораадамантан). Трифенил-, три(1-нафтил)-, тримезитилборан и их гомологи в твердом состоянии и в растворах при низких температурах имеют конформацию трехлопастного пропеллера. Производные четырехкоординированного В имеют строение правильного или искаженного тетраэдра.
Большинство органоборанов мономерны; некоторые ассоциированы за счет межмол. координации [как, напр., в (R2BONH2)2], трехцентровых двухэлектронных [напр., в (R2BH2)2] или водородных связей.
Молекулы бороксолов (RBO)3, боразолов (RBNR')3 и сосд. типа (RBS)3 представляют собой шестичленные циклы.
Органобораны — кислоты Льюиса; с основаниями (NH3, R'M, R'OM) дают комплексные соед., напр. (C2H5)3B*NH3, и органобораты, напр. М [R3BC CR'], M [R3BCN]. Комплексообразование с аминами используется для количеств. оценки стерич. напряжений.
CR'], M [R3BCN]. Комплексообразование с аминами используется для количеств. оценки стерич. напряжений.
При изучении Б. с. широко применяется спектроскопия ЯМР 11В, поскольку величины хим. сдвигов 11В определяются строением и числом заместителей при атоме В. Связь В—С ковалентная, слабополярная. Органобораны RBX2 не способны диссоциировать с образованием карбаннонов (в отличие от солей последних).
Длина связи В—С уменьшается в ряду В—Сsp3 > В—Csp2 > В—Csр, а также при уменьшении координационного числа бора. Например, длины связей В—С (нм) составляют: для (CH3)3В 0,15783, для (CH3)2BF 0,155, для (C6H5)3В 0,152, для HC≡CBF2 0,1513; для (CH3)3B*N(CH3)3 0,165, для (C6H5)4В− 0,164–0,169.
Энергия (Е) связи В—С в триалкилборанах (342–368 кДж/моль) близка к энергии связи C—C в алканах (355–368 кДж/моль). Связи В—Csр2 прочнее связей В—Csp3. Например, в (CH3)3В Е = 363 кДж/моль, в CH3BF2 400 кДж/моль, в (C6H5)2ВВг 460 кДж/моль.
По химическим свойствам Б. с. отличаются от орг. соед. Li, Mg, Al и др. металлов. Так, алкил- и арилбораны не реагируют с CO2, орг. галогенидами, эпоксидами, производными карбоновых кислот и т. д. Триалкилбораны, трициклоалкилбораны и алифатич. борацикланы не расщепляются водой, спиртами, аминами, кетонами и сложными эфирами, растворами неорг. кислот и щелочей до 100–130 °C. Это позволяет проводить многие реакции Б. с. в водных и спиртовых растворах. Однако в гидридах (R2BH)2 и (RBH2)2 связи В—Н легко расщепляются водой и спиртами.
Низшие члены рядов R3B, R2BX, а также борацикланы самовоспламеняются на воздухе (по зеленому цвету пламени судят о наличии В в соед.). Четырехкоординационные соед. В, как правило, устойчивы на воздухе.
Триарилбораны с Na или его амальгамой дают ярко-окрашенные анион-радикалы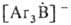 или
или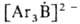 ; R2BHal(R=Alk, Ar) с К или Na-радикалы R2B, которые стабилизируются основаниями, напр. пиридином.
; R2BHal(R=Alk, Ar) с К или Na-радикалы R2B, которые стабилизируются основаниями, напр. пиридином.
Б. с. легко окисляются H2O2 в щелочной среде, CrO3, KMnO4 и др. При гидролизе или ацидолизе органоборанов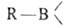 всегда образуются RH и
всегда образуются RH и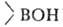 (или
(или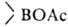 ); реакции экзотермичны, т. к. связь В—О очень прочна.
); реакции экзотермичны, т. к. связь В—О очень прочна.
В большинстве Б. с. борсодержащую группу можно заменить практически на любую функц. группу, Н, D, металл, орг. остаток и т. д., напр.:
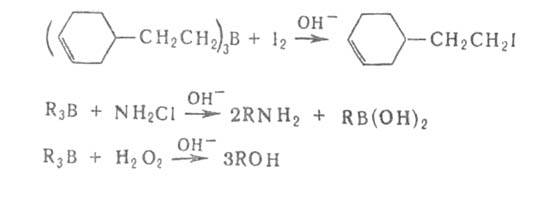
Разработаны также способы наращивания углеродной цепи при атоме бора на любое число атомов С с одновременным введением функц. группы. Органобораны электрофильны, а органобораты нуклеофильны. Первая стадия большинства реакций органоборанов — образование комплексов типа R3B*L или боратов
Реакции Б.с. можно разделить на след. типы:
Б.с. можно разделить на след. типы:
1. Обмен функц. групп при атоме В, напр.:
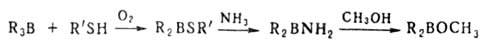
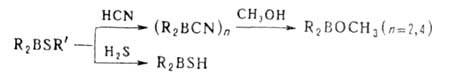
2. Электрофильное деборирование, включает протолиз, галодеборирование арилборанов, взаимод. с солями некоторых металлов и обменные реакции.
Протолиз Б.с. реагентами НХ (H2O, ROH, RCOOH, β- дикетоны, R2NH и др.) широко используется для получения разл. типов Б. с., защиты и определения OH- и NH2-групп, обезвоживания кристаллогидратов, в акваметрии. Протолиз — промежут. стадия разл. реакций, в частности "цис-гидрирования" ацетиленов, олефинов и др. непредельных соед.:
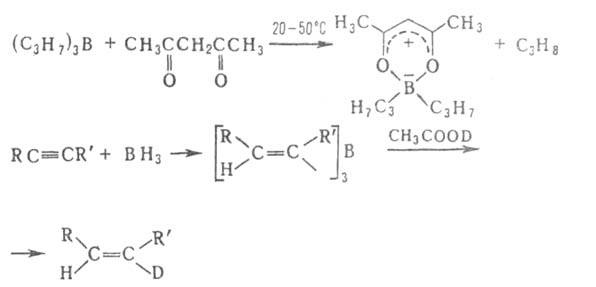
Триалкилбораны и алифатич. борацикланы реагируют с H2O, ROH, R2NH,. H2S, щелочами и неорг. кислотами при 150–200 °C с разрывом одной связи В—С; при этом образуются R2BX, RH, H2 и олефин.
В присут. каталитич. количеств меркаптанов (и следов O2) или (CH3)3ССООН температура реакции м. б. снижена до 20–70 °C Многие Б. с. расщепляются карбоновыми кислотами с образованием углеводородов (при этом конфигурация атома С в α-положении не меняется): R3B + R'COOH → 3RH.
Алкинилбораны расщепляются водой и спиртами при 0 °C, арил- и винилбораны — водой, спиртами и карбоновыми кислотами при 20–80 °C (исключение — тримезитилборан), напр.:
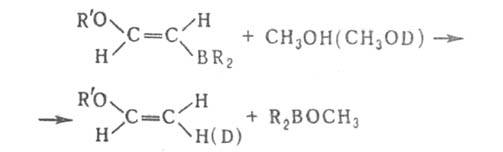
Протолиз бензил- и аллилборанов осуществляется с перегруппировкой:
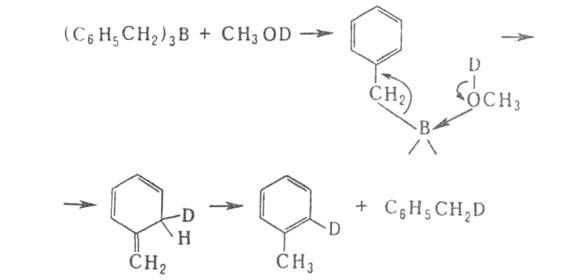
Арилбораны взаимод. с галогенами с образованием арилгалогенидов.
Типичные реакции электроф. замещения — переметаллирование, используются для получения металлоорганич. соед., напр.:
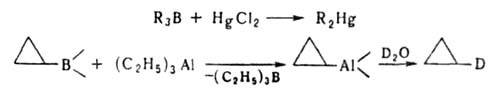
Только с использованием соответствующих Б. с. получены органические производные Ag и Cu, напр. 1-(2-хлорферроценил)серебро, циклопентадиенилмарганецтрикарбонилмедь.
Обменные реакции органоборанов (диспропорционирование и симметризация) катализируются соед., содержащими группу В—Н, напр.:
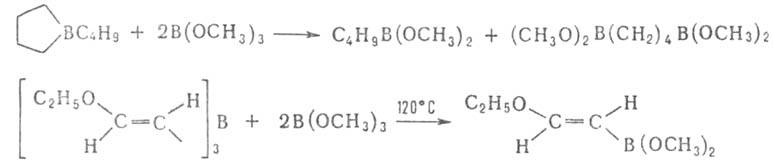
Присоединение к кратным связям не характерно для Б. с. Известно лишь неск. примеров таких реакций, напр. присоединение трибензилборана к алкоксиацетиленам (протекает с перегруппировкой):
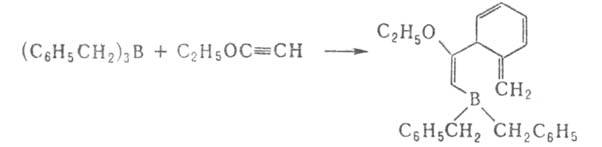
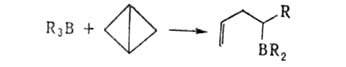
При реакциях Alk3B с циклопропенами и бициклобутаном образуются непредельные Б.с.:
3. 1,2-Анионотропные перегруппировки приводят к образованию новых связей C—C, C—O, С—S, С—N и т. д.:
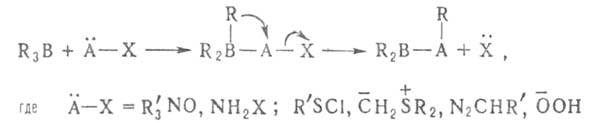
Во всех случаях сохраняется конфигурация R.
К этому типу реакций относится взаимодействие органоборанов с аминоксидами, алкилсульфенилгалогенидами, илидами, H2O2, диазосоединениями, а также перегруппировки органоборанов, содержащих электроотрицательные группы у атома С в α-положении к В, под действием нуклеофилов (R"OH, R"NH2) или электрофилов (AlCl3, ZnCl2):
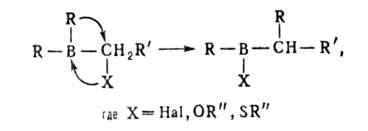
При взаимодействии органоборанов R3B и борацикланов с CO (карбонилирование) мигрируют в зависимости от температуры одна, две или три группы R:
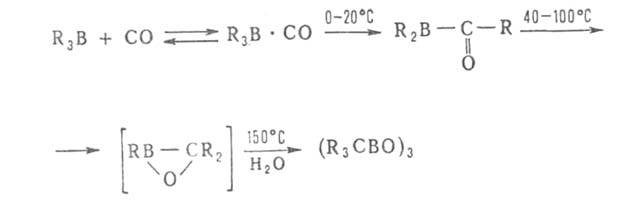
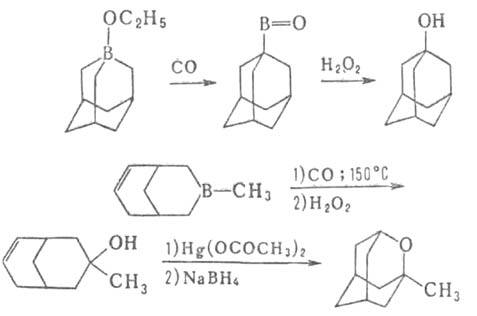
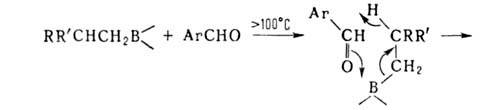
Карбонилирование применяется для синтеза спиртов, альдегидов, карбоновых кислот, в т. ч. прир. веществ, напр. ювабиона, а также циклич. и каркасных соед., напр.:
Мн. органобораты устойчивы в обычных условиях, но перегруппировываются под действием электроф. реагентов Е—У по схеме:
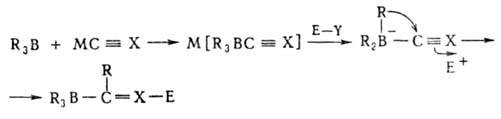
где МC≡Х = МC≡CR', MC≡N, MCH=CR2', MAr; М = = Li, Na, К; Е—Y = HCl, CH3I, (CH3)2SO4, (C2H5)3OBF4, CH2=CHCH2Br, CH3COC1 и др.
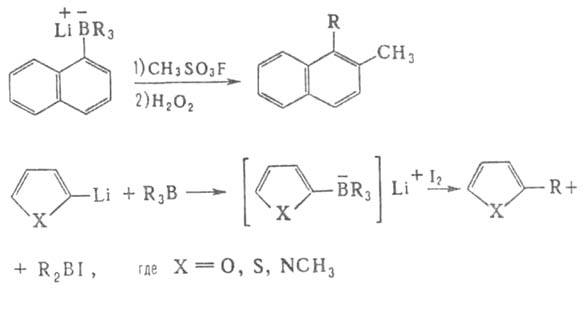
Примеры — получение замещенных кетонов и дизамещенных ацетиленов, диалкилирование ароматических соед., α- алкилирование тиофена, N-метилиндолов и фурана, напр.:
Реакция R3B с изонитрилами приводит к 2,5-диборадигидропиразинам (при 150 °C), которые при нагр. до 200 °C (или в присутствии протонных растворителей) изомеризуются в 2,5-диборапиперазины, что применяется для получения кетонов и третичных спиртов.
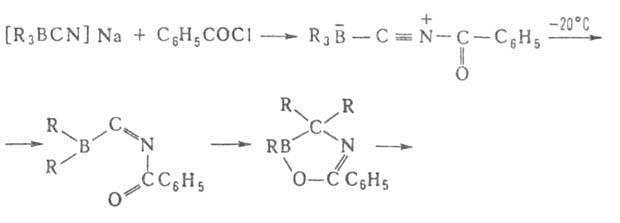
Триорганоцианобораты [R3BCN]−Na+, образующиеся при взаимодействии R3B и NaCN в воде или диглиме, устойчивы в обычных условиях, но перегруппировываются под действием HCN, (CF3CO)2O и C6H5COCl. Из образующихся при этом 1-окса-4-аза-2-борациклоент-4-енов получают амины, кетоны или третичные спирты:
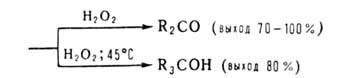
4. Радикальные реакции, первая стадия которых — гомолитич. разрыв связи В—С Включают: автоокисление (применяется в синтезе пероксидов, спиртов, гидропероксидов, полимеров); сдваивание радикалов под действием солей Ag, Cu, Au, Pt, Pd (при получении углеводородов и их производных, металлоорганич. соед.); инициируемое O2, УФ-излучением или пероксидами 1,4-присоединение R3B к непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами, диалкилдисульфидами; алкилирование некоторых олефинов, ароматич. и гетероциклич. соед.:
непредельным альдегидам и кетонам; деалкилирование триалкилборанов меркаптанами, диалкилдисульфидами; алкилирование некоторых олефинов, ароматич. и гетероциклич. соед.:
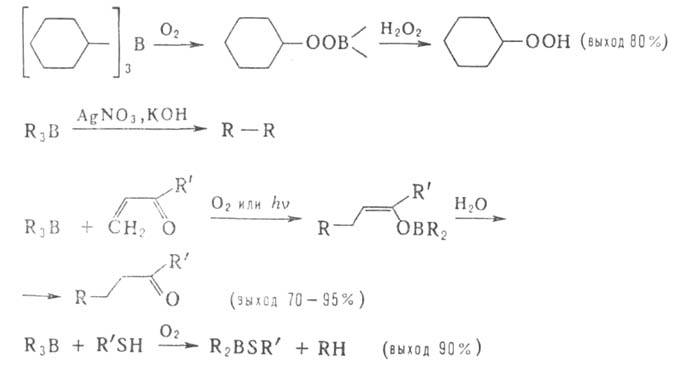
Эфиры акриловой и метакриловой кислот, их нитрилы и др. мономеры полимеризуются под действием органоборанов и следов O2 по цепному радикальному механизму.
5. Реакции с участием α-Н и Н, т. е. атомов Н соотв. в α-или
Н, т. е. атомов Н соотв. в α-или положении к атому В. При галогенировании алкилборанов замещается атом α-Н и образуются α- галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal, а под действием H2O, аминов или А1На13 перегруппировываются с образованием новой связи C—C, напр.:
положении к атому В. При галогенировании алкилборанов замещается атом α-Н и образуются α- галогеналкилбораны. Последние расщепляются выделившимся HHal, давая RHal, а под действием H2O, аминов или А1На13 перегруппировываются с образованием новой связи C—C, напр.:
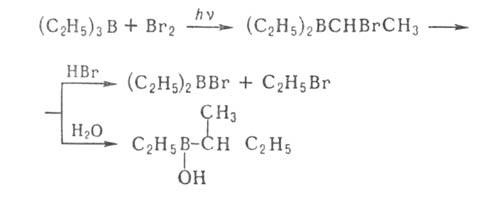
Отщепление α-Н в виде гидрид-иона — основная стадия реакций органоборатов с галогенсодержащими орг. соед. (C6H5CH2Cl, RCOC1 и др.):
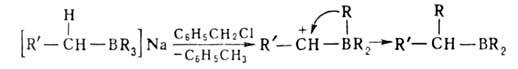
Реакции алкил- и циклоалкилборанов с участием Н: переалкилирование высшими олефинами, диенами, ацетиленами, восстановление нитрилов, ароматич. альдегидов и т. д., напр.:
Н: переалкилирование высшими олефинами, диенами, ацетиленами, восстановление нитрилов, ароматич. альдегидов и т. д., напр.:
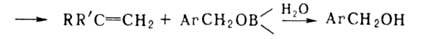
Отрыв лежит в основе синтеза олефинов из некоторых органоборатов:
лежит в основе синтеза олефинов из некоторых органоборатов:
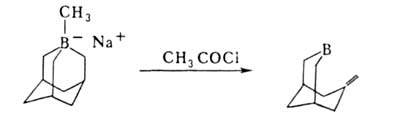
Б. с., содержащие электроотрицат. группы X (Hal, OR, SR) в или
или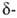 положениях к атому В, легко претерпевают элиминирование:
положениях к атому В, легко претерпевают элиминирование:
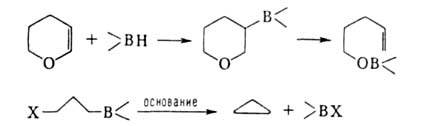
6. Термич. изомеризация, т. е. миграция В в конец углеродной цепи — уникальное свойство алкил- и циклоалкилборанов:
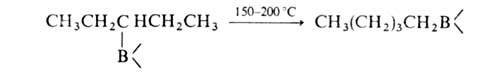
(Кат. — соед., содержащие группу В—Н.) Эта реакция используется для изомеризации неконцевых олефинов в α-олефины, метилцикленов в метиленцикланы, для синтеза первичных спиртов и т. п., напр.:
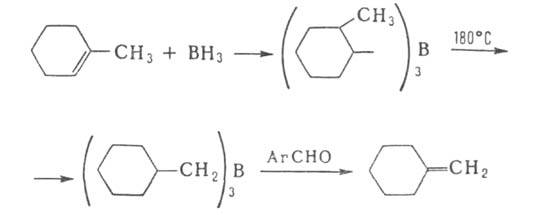
7. Преобразование заместителей при атоме В, т. е. их гидрирование, галогенирование, нитрование, циклизация и др. Один из примеров — циклизация бензоиламиномегилборной кислоты:
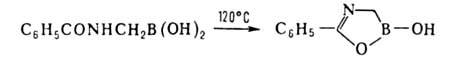
Бромированием, нитрованием, окислением и т. д. фенил- и толилборной кислот синтезированы многочисл. функциональные производные фенилборной кислоты. Группы В(OH)2 и ВCl2 ориентируют замещение в бензольном кольце в мета-положение, напр. для В(OH)2 константы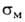 и
и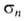 заместителя соотв. −0,01 и +0,013.
заместителя соотв. −0,01 и +0,013.
Наиболее распространенные способы получения Б.с.: 1. Переметаллирование — действие орг. соед. Li, Na, Mg, А1 и др. металлов (М) на ВХ3, RBX2, R2BX (X = Н, Hal, OR', SR', NR'), напр.:
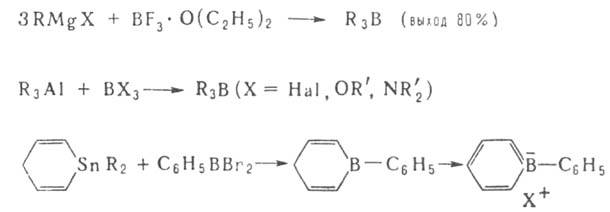
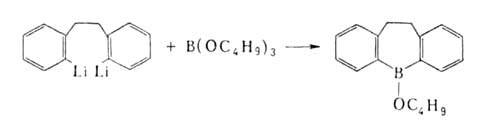
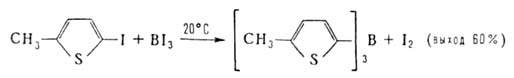
2. Окислит-восстановит. реакция ВНа13 с АгН или Arl:
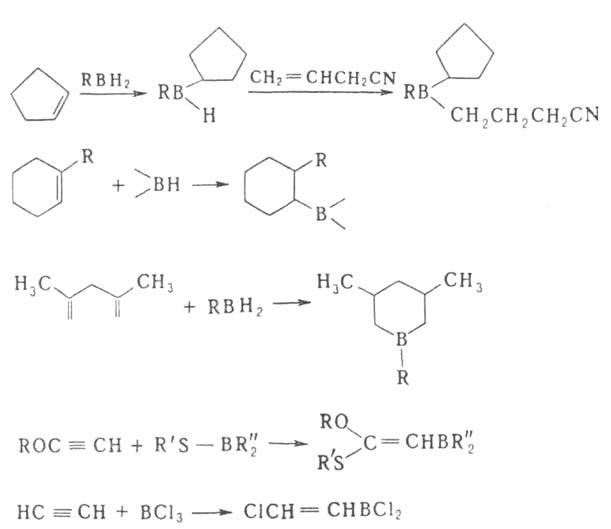
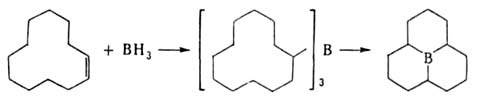
3. Гидроборирование, а также аллил-, карбо-, тио- или галоборирование олефинов, диенов, ацетиленов, алленов и циклопропанов:
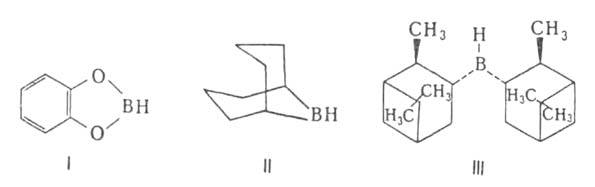
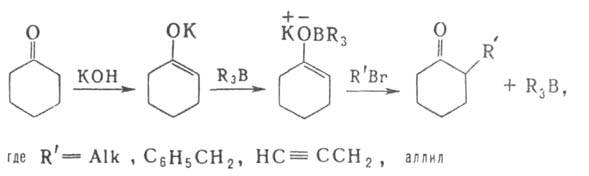
Гидроборирование-цис-присоединение веществ, содержащих группу ВН, к кратной связи. Гидроборирующими агентами служат диборан (в эфирах), комплексы борана с ТГФ, аминами, диметилсульфидом, а также получаемые из H3В*ТГФ дициклогексилборан, бис-(1,2-диметилпропил)боран (так наз. дисиамилборан), 1,1,2-триметилпропилборан (тексилборан), катехолборан (формула I); 9-борабицикло-[З.З.Пнонан (9-ББН; II), а также диизопинокам-феилооран(III) — один из широко распространенных хиральных реагентов в орг. химии.
4. Обменные реакции, катализируемые соед., содержащими группу В—Н, напр.: R3B + BX3 → R2BX+ RBX2, где X = Hal, OR', SR', NR2 и др.
5. Переалкилирование триалкилборанов высшими олефинами, ацетиленами или диенами (при 150–200 °C):
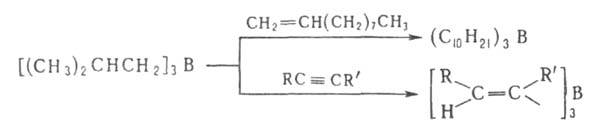
6. Пиролиз алкил- или арилборанов, Триалкилбораны, имеющие хотя бы в одном из заместителей больше трех атомов С, при 200–300 °C превращаются в борацикланы (с промежуточным образованием диалкилборанов и соответствующих олефинов), напр.:
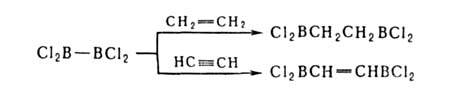
7. Диборирование олефинов, ацетиленов, циклопропанов и ароматич. соед. производными диборана, напр.:
8. Деалкилирование или деарилирование оргатюборанов, напр. при их взаимод. с галогенами и неорг. кислотами (см. выше).
Б. с. широко применяются в орг. синтезе. Органобораны алкилируют, арилируют и винилируют галоформы, тио-соед. и α-галогенкарбонильные соед. в присутствии оснований, генерирующих карбанион. Последний реагирует с органобораном с образованием α-галоген- или α-тиоалкилсодержащего Б. с., претерпевающего 1,2-анионотропную перегруппировку:
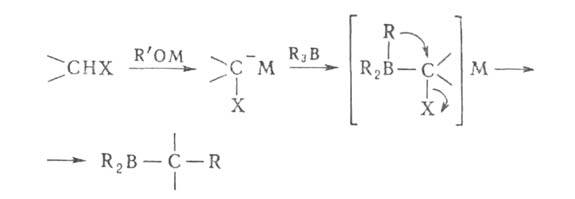
Эти реакции применяются в синтезе вторичных и третичных спиртов, альдегидов и кетонов.
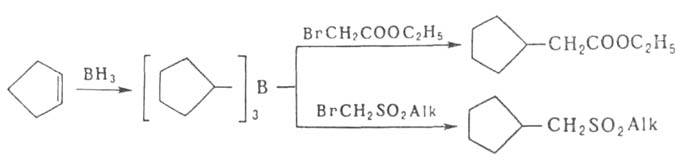
Эфиры α-галогенуксусной кислоты и α-бромметилсульфонильные эфиры алкилируются и арилируются в присутствии (CH3)3СОК, α-галогеннитрилы — в присутствии 2,6-ди-трет-бутилфенолята К:
Используются также органобораты меди Cu[R3BCH3] и комплексы RCu*BF3, в частности, для β-алкилирования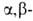 непредельных альдегидов и кетонов, производных акриловой и пропиоловой (ацетиленкарбоновой) кислот.
непредельных альдегидов и кетонов, производных акриловой и пропиоловой (ацетиленкарбоновой) кислот.
В ряде случаев R3B (R-Alk, циклоалкил) применяются для повышения селективности реакций, напр.:
Производные диборана (R2BH)2, (RBH2)2, их комплексы R2BH*L, RBH2*L [где R — Alk, Ar, OR', SR', Hal; L-диэтиловый эфир, ТГФ, (CH3)2S, R3N, пиридин и др.], а также органогидробораты M[R3BH] (R = Н, Alk, C6H5, мезитил;
K2В — борациклоалкил; K3В — борафеналил и др.) — селективные восстановители функциональных групп и кратных связей. Соединения типа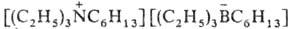 (обозначается N2226B2226) — апроточные высокополярные растворители.
(обозначается N2226B2226) — апроточные высокополярные растворители.
Применяют Б. с. также для получения бороводородов и карборанов; как добавки к моторным и реактивным топливам, смазочным маслам и красителям; как катализаторы и сокатализаторы полимеризации непредельных соед. и окисления углеводородов; антиоксиданты, бактерициды, фунгициды; реагенты в хим. анализе, напр. калигност NaB(C6H5)4 и цезигност Na[(C6H5)3ВСК] — для определения и выделения К+ , Rb+ , Cs+ , NH4+, аминов и антибиотиков; флавогност (C6H5)2BOCH2CH2NH2 — для определения, идентификации и характеристики флавонов и выделения антибиотиков. Некоторые Б. с. используют в медицине, в частности для нейтронной терапии раковых опухолей.
Лит.: Михайлов Б. М., Бубнов Ю. Н., Борорганические соединения в органическом синтезе, М., 1977; Пел тер А., Смит К., в кн.: Общая органическая химия, пер. с англ., т. 6, ч. 14, М., 1984, с. 233–537; KliegelW., Вог in Biologic, Medizin und Pharmazic, B.-[u. a.], 1980.
Ю. Н. Бубнов
Значения в других словарях
- Борорганические соединения — Органические соединения, атом бора в которых соединён с органическим радикалом. К борорганическим соединениям относятся борорганические кислоты типа RB (OH)2 и R2B (OH) (где R — алифатические... Большая советская энциклопедия
- БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — БОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — содержат в молекуле атом бора, непосредственно связанный с атомом углерода. Наиболее известны соединения типа RnBX3-n (органобораны) — где R — органический радикал, X — галоген, водород, OH, OR и др., n=1-3. Большой энциклопедический словарь
