циклофаны
ЦИКЛОФАНЫ (фаны)
мостиковые макроциклич. системы, включающие ароматич. и (или) гетероароматич. кольца, соединенные между собой алифатич. цепочками.
Первоначально Ц. наз. системы, включающие бензольные кольца, связанные по пара- или мета-положениям полиметиленовыми цепочками (соед. I-VI). В настоящее время к Ц. относят также конденсированные системы с орто-расположенными мостиками (VII); соед., содержащие одно ароматич. (гетероароматич.) кольцо с одним мостиком (VIII, анса-соединения); соед. с гетероароматич. (IX) или небензоидными ароматич. кольцами; системы, в которых одна или неск. мети-леновых групп заменены гетероатомами либо содержат в алифатич. цепочках разл. функц. группы и кратные связи (X, XI). Различают Ц., содержащие только ароматич. кольца (карбофаны), гетероароматич. (гетерофаны) и смешанные циклофаны. Ц., содержащие в алифатич. цепочках гетероатомы, наз. гетерофанами.
Номенклатура. Систематич. названия карбофанов, включающих только бензольные кольца, содержат в качестве основы "циклофан", перед основой помещают цифры (в квадратных скобках), количество их соответствует числу мостиков, а значения — числу метиленовых групп, и префикс(ы) орто-, мета- и пара-, обозначающие тип замещения в бензольных кольцах, напр. [2.2] парациклофан (I), [2.2]метапарациклофан (II), [2.2.2.2]парациклофан (III), [2.0.2.0]парациклофан (IV), [2.2]ортоциклофан (VII), [6]парациклофан (VIII). Назв. Ц., включающих ароматич. кольца, отличные от бензольного, а также гетероароматич. кольца, содержат назв. соответствующего цикла с окончанием "фан", перед которым в круглых скобках цифрами записывают положения атомов цикла, к которым присоединен мостик, напр. 1,12-дитиа-[2.2](2,7)нафгалинофан (X). При наличии в молекуле разл. ароматич. (гетероароматич.) колец их назв. указывают последовательно и используют окончание "фан", напр. [2]парацикло[2](2,6)пиридинофан (IX). В назв. Ц., содержащих более двух мостиков, а также т. наз. слоистых или многослойных Ц. префиксы орто-, мета- и пара- не используют, а применяют цифровую систему обозначений, напр. [4.4.4](1,3,5)циклофан (V), [2.2](1,4)(1,3)[2.2](4,6)(1,4)циклофан (VI).
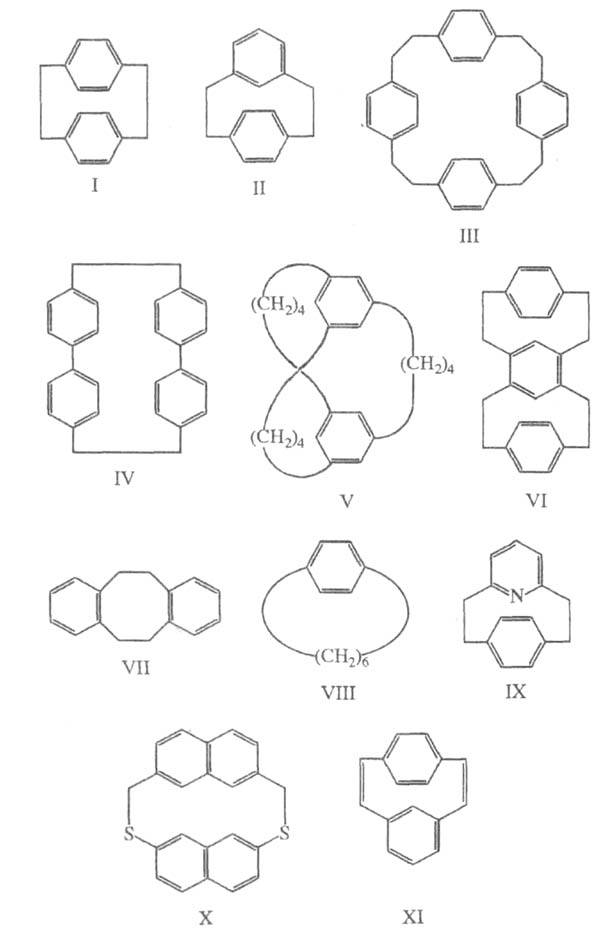
Наличие в Ц. заместителей или кратных связей указывают в их назв. с использованием обычных суффиксов и префиксов, напр. [2.2]метапарациклофан-1,9-диен (XI). Названия Ц., имеющих цепочки одинаковой длины, м. б. записаны сокращенно, напр. [24]парациклофан (III). Некоторые Ц. имеют тривиальные назв., напр. производные [1.1.1.1](2,5)пирролофана — порфирины, а [1.1.1.0](2,5)пирролофана — коррины
(см. корриноиды); большая группа гидроксилированных [1n]метациклофанов — производных пара-замещенных фенолов — носит назв. каликсарены, что отражает их пространств. строение (от лат. calix — чаша, кубок), напр. каликс[6]арен (XII).
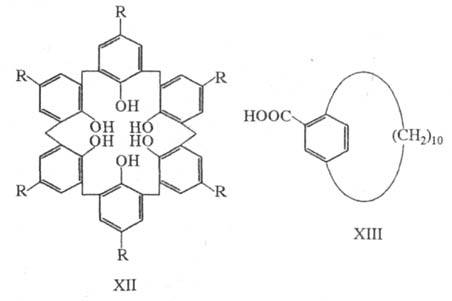
Свойства Ц. обусловленны напряженностью молекул и трансаннулярным взаимод.π-электронной ареновой или гетареновой системы с др. кольцом, фрагментом мостика или заместителем на "противоположной" стороне макроцикла. В низших [2.2]пара- и метациклофанах и [3.3]пара- и метацик-лофанах наблюдается даже искажение планарности бензольных колец. Невозможность вращения ароматич. кольца в Ц. приводит к существованию некоторых монозамещенных, напр. кислоты ХIII, в виде оптич. изомеров. Функциональные замещенные Ц. проявляют способность к образованию комплексов с ионами и молекулами по типу "хозяин — гость". Некоторые из этих комплексов по сродству к ионам напоминают краун-эфиры. Например, каликсарен XII (R = COOH) обладает значительно более высоким сродством и селективностью по отношению к катиону уранила по сравнению с др. соед.; такие Ц. могут быть использованы для извлечения металлов из морской воды. Синтезированы комплексы, содержащие фрагменты Ц. и краун-эфиров (кавитанды, карцеранды), представляющие интерес как системы для мол. распознавания.
Получение. Ц. получают из производных ароматич. и гетероароматич. соединений. Так, [2.2]парациклофан м. б. синтезирован из 4,4'-дибромметил-1,2-дифенилэтана по реакции Вюрца. Для получения высших парациклофанов используют циклизацию сложных эфиров в условиях внутримол. ацилоиновой конденсации. Специфич. метод получения [2.2]парациклофанов, [2,2]ортоциклофанов и их аналогов — расщепление четвертичных аммониевых оснований по реакции Гофмана, напр.:
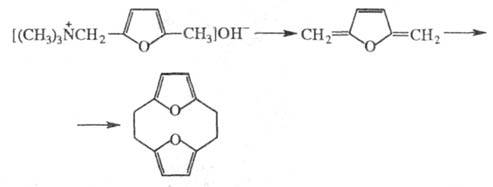
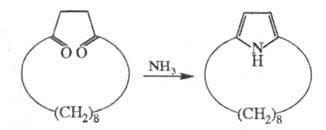
Второй путь синтеза — построение структуры Ц. на основе алициклич. или гетероциклич. систем. Например, [6]метациклофан м. б. получен из конденсир. алициклич. системы, включающей 5- и 8-членные циклы, а [8]пирролофан — из циклододекан-1,4-диона:
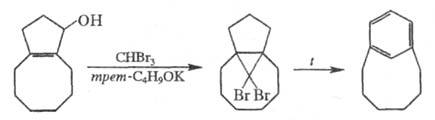
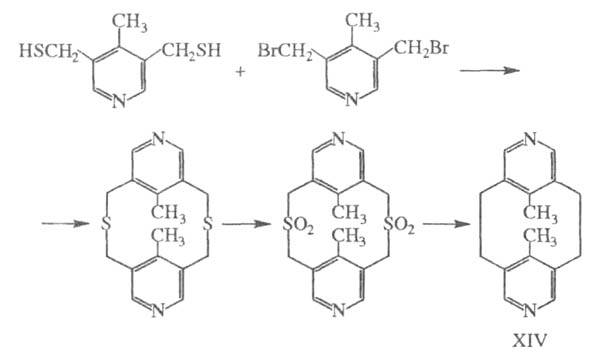
Третий путь синтеза — превращение одних Ц. в другие. При этом наиб. значение имеет экструзия SO2 из макроциклич. сульфонов либо фотолитич. экструзия серы из тиациклофанов. Например, пиридинофан XIV получают по схеме:
Соед. формулы II м. б. получено изомеризацией соед. I под действием AlCl3.
Применение. Перспективные области использования Ц. — создание искусств. ферментов и рецепторов, электропроводящих орг. материалов, ион-селективных электродов, катализаторов фазового переноса, систем для разделения молекул путем захвата во внутр. полость частиц лишь определенных размеров и др. Некоторые полимерные Ц. обладают свойствами комплексов с переносом заряда.
Лит.: Гольдфарб Я. Л., Беленький Л. И., "Успехи химии", 1957, т. 26, в. 3, с. 362–87; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 437–42; Новое в жизни, науке и технике, сер. Химия, 1989, № 1,2; Vоgtle F., NeumannP., "Synthesis", 1973, №2, p. 85–103; Ferguson J., "Chem. Rev.", 1986, v. 86, № 6, p. 957–82.
Л. И. Беленький
