цинхомероновая кислота
ЦИНХОМЕРОНОВАЯ КИСЛОТА (пиридин-3,4-дикарбоновая кислота)
мол. м. 167,12; бесцветные кристаллы, т. пл. 266–268 °C. Раств. в воде, плохо — в разл. органических растворителях.
При нагр. выше температуры плавления Ц. к. декарбоксилируется с образованием смеси никотиновой и изоникотиновой кислот, при взаимодействии с (CH3СО)2O превращается в ангидрид,т. пл. 67 °C.
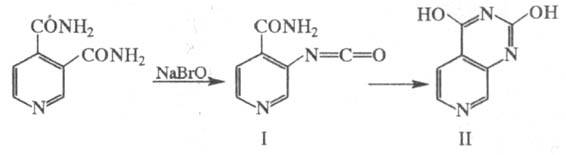
Спиртами этерифицируется с образованием моно- или диалкиловых эфиров, напр. взаимод. с CH3OH приводит к диметиловому эфиру (т. кип. 168–171 °C/28 мм рт. ст.), который при частичном гидролизе по положению 4 превращается в 3-метоксикарбонилизоникотиновую кислоту; взаимод. CH3OH с ангидридом Ц. к. приводит к 4-метоксикарбонилникотиновой кислоте. Моноэфиры Ц. к. при реакции с NH3 превращаются в соответствующие амиды, которые под действием NaBrO по реакции Гофмана дают аминопиридинкарбоновые кислоты. Диамид Ц. к. в аналогичных условиях образует изоцианат (формула I), самопроизвольно превращающийся в циклич. соед. II:
Восстановление Ц. к. Na в этаноле приводит к пиперидин-3,4-дикарбоновой кислоте.
Получают Ц. к. (наряду с фталевым ангидридом) окислением щелочным раствором KMnO4 изохинолина (или его 5- и 8-аминопроизводных) либо 3,4-диалкилпиридинов, а также частичным декарбоксилированием пиридин-2,3,4-трикарбоновой кислоты.
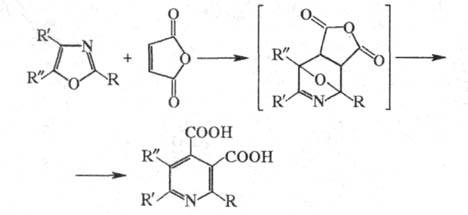
Важный путь синтеза замещенных Ц. — взаимод. оксазолов с малеиновым ангидридом по реакции Дильса — Альдера:
Лит.: Гетероциклические соединения, пер. с англ., т. 1, М., 1953, с. 447–48; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 272.
Л. Н. Яхонтов
Значения в других словарях
- Цинхомероновая кислота — См. Пиридин. Энциклопедический словарь Брокгауза и Ефрона
