циркония галогениды
ЦИРКОНИЯ ГАЛОГЕНИДЫ
Дигалогениды ZrX2 — черные кристаллы (табл.). Тригалогениды ZrX3 — голубовато-серые, темно-синие или черные кристаллы, которые могут существовать в сравнительно широких областях гомогенности, диспропорционируют или разлагаются при натр., легко окисляются на воздухе, не раств. в воде; получают их восстановлением соответствующих тетрагалогенидов. Тетрагалогениды ZrX4 — бесцветные кристаллы, гидролизуются водой (ZrF4 — медленно). Галогеноцирконаты(IV) — бесцветные кристаллы.
Тетрафторид ZrF4:  64,4 кДж/моль,
64,4 кДж/моль, 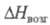 215,9 кДж/моль (1179 К); уравнение температурной зависимости давления пара lgр (Па) = 15,6818 — 12430/Т (681–913 К); умеренно раств. в воде (15 г/л), лучше — в разб. кислотах; образует моно- и тригидрат, фтороциркониевые кислоты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O, H2ZrF6 х nH2O, (H3O)2ZrF6, многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6, (NH4)3ZrF7, Ba2ZrF8, K2NiZr2F12, Na5Zr3F17. Получают из водных растворов солей Zr(IV) действием фтористоводородной кислоты с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2 или HF при 400–500 °C, термич. разложением (NH4)2ZrP6 или (NH4)3ZrF7 при 350–450 С. Применяют ZrF4 как промежут. вещество при металлотермич. производстве Zr, компонент фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров и хим. сенсоров.
215,9 кДж/моль (1179 К); уравнение температурной зависимости давления пара lgр (Па) = 15,6818 — 12430/Т (681–913 К); умеренно раств. в воде (15 г/л), лучше — в разб. кислотах; образует моно- и тригидрат, фтороциркониевые кислоты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O, H2ZrF6 х nH2O, (H3O)2ZrF6, многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6, (NH4)3ZrF7, Ba2ZrF8, K2NiZr2F12, Na5Zr3F17. Получают из водных растворов солей Zr(IV) действием фтористоводородной кислоты с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2 или HF при 400–500 °C, термич. разложением (NH4)2ZrP6 или (NH4)3ZrF7 при 350–450 С. Применяют ZrF4 как промежут. вещество при металлотермич. производстве Zr, компонент фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров и хим. сенсоров.
Гексафтороцирконат(IV) калия K2ZrF6 умеренно раств. в воде; получают осаждением из растворов ZrF4 или (NH4)2ZrF6 действием солей К, в промышленности — взаимод. рудных цирконовых концентратов с K2SiF6 при 600–700 °C; промежут. вещество для электролитич. производства Zr. Гептафтороцирконат(IV) аммония (NH4)3ZrF7 разлагается при 300–400 °C с последоват. образованием (NH4)2ZrF6, NH4ZrF5 и ZrF4; хорошо раств. в воде; получают взаимод. ZrO2 с NF4HF2, при 150–200 °C; применяют для производства особо чистого ZrF4 и получения др. фтороцирконатов. Оксифториды ZrOF2, Zr3OF10, Zr3O2F8, Zr4OF14, Zr2OF6, Zr7O9F10 и др. — бесцветные кристаллы; получают взаимод. ZrF4 с ZrO2, как промежут. продукты пирогидролиза ZrF4 или фторирования ZrO2.
ХАРАКТЕРИСТИКА ГАЛОГЕНИДОВ ЦИРКОНИЯ
таблица в процессе добавления
* Температура полиморфного перехода. ** Температура возгонки.
Трихлорид ZrCl3 при нагр. диспропорционирует с выделением ZrCl4 и последоват. образованием ZrCl2,8 (200 °C), ZiCl1,6 (300 °C), ZrCl (450 °C) и Zr (600 °C, вакуум). Тетрахлорид ZrC4: 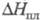 49 кДж/моль,
49 кДж/моль, 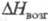 103 кДж/моль; tкрит 503,5 °C, pкрит 5,7 МПа; уравнение температурной зависимости давления пара lg p (Па)= 13,8-5700/Т для твердого и lgp (Па) = 11,4 — 3500/Т для жидкого ZrCl4; раств. в этаноле, диэтиловом эфире, образует аддукты с кислотами Льюиса (напр., ZrCl4 * PCl5, ZrCl4*2CH3CN и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6, BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с Cl2 или HCl выше 300 °C, ZrO2 с CCl4 или COCl2 выше 300 °C, смеси ZrO2 и С с Cl2 выше 600 °C, карбида Zr с Cl2 выше 400 °C; используют как промежут. продукт в производстве Zr, исходное вещество для магниетермич. восстановления, катализатор орг. реакций (напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6, т. пл. 799 °C, температура полиморфного перехода 622 °C,
103 кДж/моль; tкрит 503,5 °C, pкрит 5,7 МПа; уравнение температурной зависимости давления пара lg p (Па)= 13,8-5700/Т для твердого и lgp (Па) = 11,4 — 3500/Т для жидкого ZrCl4; раств. в этаноле, диэтиловом эфире, образует аддукты с кислотами Льюиса (напр., ZrCl4 * PCl5, ZrCl4*2CH3CN и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6, BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с Cl2 или HCl выше 300 °C, ZrO2 с CCl4 или COCl2 выше 300 °C, смеси ZrO2 и С с Cl2 выше 600 °C, карбида Zr с Cl2 выше 400 °C; используют как промежут. продукт в производстве Zr, исходное вещество для магниетермич. восстановления, катализатор орг. реакций (напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6, т. пл. 799 °C, температура полиморфного перехода 622 °C, 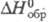 −1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,- бесцветные кристаллы, при нагр. выше 70 °C в водном растворе гидролизуются; промежут. продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются также при растворении соед. Zr в соляной кислоте. Октагидрат ZrOCl2 * 8H2O хорошо раств. в воде (67% при 25 °C) и гораздо хуже в соляной кислоте, его применяют для получения небольших партий особо чистых соед. Zr перекристаллизацией.
−1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,- бесцветные кристаллы, при нагр. выше 70 °C в водном растворе гидролизуются; промежут. продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются также при растворении соед. Zr в соляной кислоте. Октагидрат ZrOCl2 * 8H2O хорошо раств. в воде (67% при 25 °C) и гораздо хуже в соляной кислоте, его применяют для получения небольших партий особо чистых соед. Zr перекристаллизацией.
Тетраиодид ZrI4: 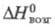 119 кДж/моль; уравнение температурной зависимости давления пара lg р (Па) = 22,99 −7,680/742,164 lg Т — 1,344∙10−3 T (298–704 К), в парах выше 1200 °C разлагается до Zr; раств. в этаноле, бензоле; получают взаимод. Zr (реже ZrO2) с I2 при 300–500 °C; промежут.
119 кДж/моль; уравнение температурной зависимости давления пара lg р (Па) = 22,99 −7,680/742,164 lg Т — 1,344∙10−3 T (298–704 К), в парах выше 1200 °C разлагается до Zr; раств. в этаноле, бензоле; получают взаимод. Zr (реже ZrO2) с I2 при 300–500 °C; промежут.
продукт при иодидном рафинировании Zr.
Э. Г. Раков
