Дебая — Хюккеля теория
ДЕБАЯ — ХЮККЕЛЯ ТЕОРИЯ
статистич. теория разбавленных растворов сильных электролитов, позволяющая рассчитать коэф. активности ионов. Основана на предположении о полной диссоциации электролита на ионы, которые распределены в растворителе, рассматриваемом как непрерывная среда. Каждый ион действием своего электрич. заряда поляризует окружение и образует вокруг себя некоторое преобладание ионов противоположного знака — т. наз. ионную атмосферу. В отсутствие внеш. электрич. поля ионная атмосфера имеет сферич. симметрию и ее заряд равен по величине и противоположен по знаку заряду создающего ее центр. иона. Потенциал j суммарного электрич. поля, создаваемого центр. ионом и его ионной атмосферой в точке, расположенной на расстоянии r от центр. иона, м. б. рассчитан, если ионную атмосферу описывать непрерывным распределением плотности ρ заряда около центр. иона. Для расчета используют уравнение Пуассона (в системе СИ):
n2j = -r/ee0,
где n2-оператор Лапласа, e — диэлектрич. проницаемость растворителя, ε0 — электрич. постоянная (диэлектрич. проницаемость вакуума). Для каждого i-го сорта ионов ρ описывается функцией распределения Больцмана; тогда в приближении, рассматривающем ионы как точечные заряды (первое приближение Д.-Х.т.), решение уравнения Пуассона принимает вид:
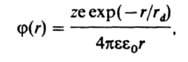
где z — зарядовое число центр. иона, rd — т. наз. дебаевский радиус экранирования (радиус ионной атмосферы). На расстояниях r > rd потенциал j становится пренебрежимо малым, т. е. ионная атмосфера экранирует электрич. поле центр. иона. Величина rd равна радиусу сферы, заряд которой равен заряду центр. иона и которая создает в месте нахождения центр. иона такой же потенциал, что и ионная атмосфера; значение rd выражается формулой:
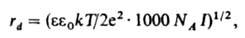
где k — постоянная Больцмана, Т — температура, NA — постоянная Авогадро, I — т. наз. ионная сила раствора, зависящая от состава. Она определяется выражением:
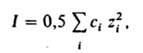
где сi — молярная концентрация i-го иона в моль/см3, zi — его зарядовое число; суммирование производится по всем типам ионов, присутствующих в растворе. Д.-Х.т. дает возможность рассчитать средний ионный коэф. активности из выражения (предельный закон Дебая — Хюккеля):
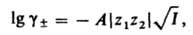
где коэф. А выражается формулой:
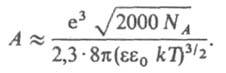
Для водных растворов при 25 °C А = 0,51. Согласно правилу Льюиса-Рендалла, коэф. активности данного типа ионов не зависит от типа др. присутствующих в растворе ионов, а зависит только от ионной силы раствора. Д.-Х. т. широко используют для расчета коэф. активности ионов в разбавленных растворах и концентрац. зависимости осмотич. коэффициентов. В первом приближении теория удовлетворительно описывает свойства растворов 1,1-валентных электролитов в области концентраций до 0,01 М, а для др. электролитов и неводных растворов — в меньшем диапазоне концентраций. Введение поправок, учитывающих конечный размер ионов (второе приближение) и уменьшение ε вблизи ионов (третье приближение), позволяет применять Д.-Х. т. в более широком диапазоне концентраций; для водных растворов 1,1-валентных электролитов — до 0,1 М. Уравнение для расчета коэф. активности в третьем приближении Д.-Х. т. имеет вид:
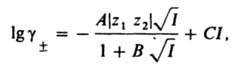
где В и С — эмпирич. постоянные. Ограниченность Д.-Х.т. обусловлена пренебрежением ассоциаций ионов, представлением о растворителе как о непрерывной среде, характеризуемой только значением ε, т. е. неучетом мол. структуры растворителя и его взаимод. с ионами. Д.-Х. т. является основой теории электропроводности разбавл. растворов сильных электролитов, разработанной Л. Онсагером. Она позволяет объяснить увеличение электропроводности раствора при повышении напряженности постоянного электрич. поля (эффект Вина) и в высокочастотном поле (эффект Дебая-Фалькенхагена). В этих условиях ионная атмосфера, тормозящая движение ионов, не успевает образоваться (см. электропроводность электролитов). Теория создана П. Дебаем и Э. Хюккелем в 1923.
Лит.: Робинсон Р., Стокc Р., Растворы электролитов, пер. с англ., М., 1963, с. 269–81; Измайлов Н. А., Электрохимия растворов, 3 изд., М., 1976, с. 68–89.
А. И. Мишустин
