действующих масс закон
ДЕЙСТВУЮЩИХ МАСС ЗАКОН
при установившемся хим. равновесии между реагентами и продуктами реакции выполняется равенство 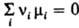 , где mi — хим. потенциал i-го компонента системы, ni — eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов реакции — положительный). Если реагирующие вещества и продукты реакции можно рассматривать как идеальные газы, mi выражается через парциальное давление pi:
, где mi — хим. потенциал i-го компонента системы, ni — eгo стехиометрич. коэф. (для реагентов он отрицательный, для продуктов реакции — положительный). Если реагирующие вещества и продукты реакции можно рассматривать как идеальные газы, mi выражается через парциальное давление pi:
mi = mi0 (T) + RT ln pi,
где R — газовая постоянная, Т — температура, mi0 (T) — не зависящая от давления составляющая mi. С помощью этого соотношения Д. м. з. можно выразить равенством:
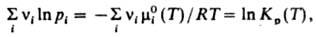
где Kр(Т)- константа равновесия реакции. Часто левую часть этого равенства записывают в виде произведения: 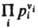 = Kр(Т). Поскольку для идеальных газов pi = сiRТ, где сi — молярная концентрация i-го вещества, справедливо след. выражение Д. м. з.:
= Kр(Т). Поскольку для идеальных газов pi = сiRТ, где сi — молярная концентрация i-го вещества, справедливо след. выражение Д. м. з.: 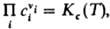 , т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия реакции Kр(Т)и Kc(Т)связаны соотношением:
, т. е. Д. м. з. выражает взаимосвязь концентраций компонентов системы при хим. равновесии. Константы равновесия реакции Kр(Т)и Kc(Т)связаны соотношением:
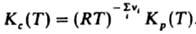
Для реальных газов хим. потенциал выражают через летучести fi компонентов и Д. м. з. записывают в виде: 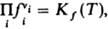 численные значения констант равновесия Kf(T)и Kр(Т)совпадают. Для реакций в разбавл. растворах Д. м. з. связывает концентрации реагирующих и образующихся в растворе частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для реакций в растворах константа зависит, вообще говоря, не только от температуры, но и от внеш. давления р. Так,
численные значения констант равновесия Kf(T)и Kр(Т)совпадают. Для реакций в разбавл. растворах Д. м. з. связывает концентрации реагирующих и образующихся в растворе частиц (молекул или ионов). При записи Д. м. з. могут использоваться разл. единицы концентрации, что влияет на значение константы равновесия. Для реакций в растворах константа зависит, вообще говоря, не только от температуры, но и от внеш. давления р. Так, 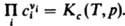 При невысоких давлениях зависимостью К от р обычно пренебрегают. В общем случае для реакций в растворах Д. м. з. выражают через активности аi компонентов:
При невысоких давлениях зависимостью К от р обычно пренебрегают. В общем случае для реакций в растворах Д. м. з. выражают через активности аi компонентов: 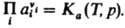 Константа равновесия Kа связана со стандартными хим. потенциалами веществ mi0(Т, р) соотношением:
Константа равновесия Kа связана со стандартными хим. потенциалами веществ mi0(Т, р) соотношением: 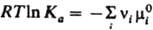 , где mi0 — хим. потенциал i-го вещества при ai = 1. В хим. кинетике Д. м. з. выражает скорость v реакции через концентрации реагентов. Для простой реакции nAA + nBB → продукты, где А и В — реагирующие вещества, nA и nВ — их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости реакции, не зависящая от концентраций реагентов [А] и [В]. Для сложных реакций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая реакция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости реакции и в стехиометрич. уравнении реакции часто различны. Если реакция протекает обратимо с константами скорости k1 и k_1, напр.:
, где mi0 — хим. потенциал i-го вещества при ai = 1. В хим. кинетике Д. м. з. выражает скорость v реакции через концентрации реагентов. Для простой реакции nAA + nBB → продукты, где А и В — реагирующие вещества, nA и nВ — их стехиометрич. коэф., v = K[А]nA[В]nВ, К-константа скорости реакции, не зависящая от концентраций реагентов [А] и [В]. Для сложных реакций Д. м. з. в общем случае не справедлив, однако он нередко выполняется, если такая реакция имеет одну или неск. лимитирующих стадий. В этом случае, однако, значения nA и nВ в выражениях для скорости реакции и в стехиометрич. уравнении реакции часто различны. Если реакция протекает обратимо с константами скорости k1 и k_1, напр.:
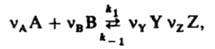
где Y и Z — продукты, nY и nZ — их стехиометрич. коэф., то в условиях равновесия скорости прямой и обратной реакций равны:
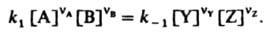
Отсюда следует, что
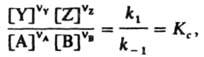
где Kс — константа равновесия реакции. Д. м. з. широко используется для расчета равновесных концентраций продуктов реакции; он позволяет также предсказать направление, в котором смещается хим. равновесие при изменении условий протекания реакции. Для необратимых реакций Д. м. з. позволяет рассчитать скорость реакции при любых концентрациях реагентов, если известна константа скорости реакции. Д. м. з. был установлен К. Гульдбергом и П. Вааге в 1864–67; его строгий термодинамич. вывод получен Дж. Гиббсом в 1875–78.
Е. Т. Денисов
Значения в других словарях
- Действующих масс закон — Один из основных законов физической химии... Большая советская энциклопедия
- ДЕЙСТВУЮЩИХ МАСС ЗАКОН — ДЕЙСТВУЮЩИХ МАСС ЗАКОН: скорость элементарной стадии химической реакции при постоянной температуре пропорциональна концентрациям реагирующих веществ в степенях — равных их стехиометрическим коэффициентам в уравнении этой стадии. Большой энциклопедический словарь
