детального равновесия принцип
ДЕТАЛЬНОГО РАВНОВЕСИЯ ПРИНЦИП в химической кинетике
связывает кинетич. характеристики прямого и обратного микроскопич. процессов (квантового перехода или элементарной хим. реакции), происходящих при соударениях частиц (атомов, молекул). В рамках динамич. описания системы взаимодействующих частиц, при котором вероятность процесса определяется энергией каждой частицы, изменение энергии при соударениях характеризуется сечением перехода или сечением реакции (см. столкновений теория). Переходы частицы из начального квантового состояния а в конечное b и обратно происходят при определенных значениях энергии относит. движения частиц (соотв. Eat и Ebt). Внутр. энергия частицы в обоих рассматриваемых состояниях (соотв. Еа и Eb) связана с Eat и Ebt законом сохранения:
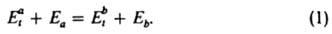
Д. р. п. устанавливает след. соотношение между сечениями 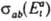 и
и 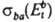 прямого и обратного переходов:
прямого и обратного переходов:
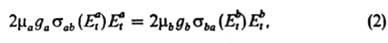
где ma и mb — приведенные массы сталкивающихся частиц, gа и gb- статистич. веса состояний (кратность вырождения). В такой форме Д. р. п. выводится из законов механики на основе обратимости уравнений движения частиц при изменении знака времени. В рамках статистич. описания системы как макроскопически наблюдаемого ансамбля частиц рассматриваются распределения частиц по их квантовым состояниям и энергиям до и после соударения. Д. р. п. устанавливает соотношение между константами скорости прямой и обратной реакций (соотв. каb и кbа). В частности, если имеет место максвелловское распределение частиц по скоростям (или энергиям поступат. движения), определяемое абс. температурой Т, то
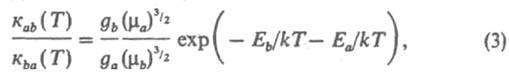
где k — постоянная Больцмана. В результате реакций в системе устанавливается равновесное максвелл-больцмановское распределение частиц по энергиям для всех степеней свободы взаимодействующих частиц в процессе тепловой релаксации. После установления такого равновесия отношение макроскопич. констант скорости к и к' прямой и обратной реакций равно константе равновесия К (Т):
к/к' = К(Т). (4)
В форме (4) Д. р. п. позволяет в отсутствие хим. равновесия рассчитывать константу скорости прямой реакции по константе скорости обратной реакции и известной константе равновесия. Часто при формулировке Д. р. п. принимают в качестве исходного предположение о равенстве скоростей прямого и обратного процессов при равновесии и получают соотношение типа (3). Однако при таком подходе остается нераскрытым смысл Д. р. п. на динамич. уровне рассмотрения системы. Между тем для неравновесных реакций, когда нельзя однозначно определить температуру системы, Д. р. п. может быть использован только в виде соотношения типа (2).
Лит. см. при статьях динамика элементарного акта, неравновесная химическая кинетика.
Е. Е. Никитин
Значения в других словарях
- ДЕТАЛЬНОГО РАВНОВЕСИЯ ПРИНЦИП — Общее положение статистической физики, согласно к-рому любой микропроцесс в равновесной системе протекает с той же скоростью, что и обратный ему. Физический энциклопедический словарь
- Детального равновесия принцип — Общее положение статистической физики (См. Статистическая физика), согласно которому любой микроскопический процесс в равновесной системе протекает с той же скоростью, что и обратный ему. Большая советская энциклопедия
- ДЕТАЛЬНОГО РАВНОВЕСИЯ ПРИНЦИП — ДЕТАЛЬНОГО РАВНОВЕСИЯ ПРИНЦИП — утверждает, что при статистическом равновесии любой микроскопический процесс протекает с той же вероятностью, что и обратный ему процесс. Большой энциклопедический словарь
