дейтерирование
ДЕЙТЕРИРОВАНИЕ
введение атома дейтерия в молекулу орг. соединения. Наиб. известно гетеролитич. замещение атома водорода, катализируемое основаниями (изотопный обмен водорода, дейтерообмен):
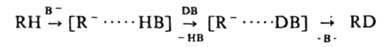
В = OD, OR и др. Легкость замещения возрастает с увеличением кислотности вещества и основности катализатора В−. В средах с высокой кислотностью возможен непосредственный электроф. обмен. Так, обмен атома Н в ароматич. углеводородах обычно протекает в среде неорг. кислот; в алифатич. — только в среде т. наз. сверхкислот, напр., в HS03F-SbF5:
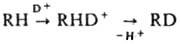
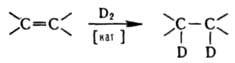
Известно также замещение атома водорода, катализируемое переходными металлами и их соед., напр., солями Cr (III), оксидами Mg и Al, K2PtCl4. В качестве донора дейтерия обычно используют D2, D2O или дейтерированные орг. соед., напр. (CD3)2 SO. Д. орг. соед. может также осуществляться при: а) дейтеролизе связи элемент — металл под действием кислот: R-M + DX → RD + MX; б) нуклеоф. замещении атома галогена или тозильной группы под действием доноров дейтерид-иона, напр.: RX + LiAlD4 → RD + LiAlD3X; в) радикальном замещении атома галогена под действием триалкилдейтеростаннанов: RX + (C4H9)3 SnD → RD + (C4H9)3SnX; г) присоединении дейтеросодержащих агентов к кратным связям C=C, C=C, C=O и др. Наиб. известно присоединение D по связи C=C [кат. — Pd на угле или комплексы металлов типа трис-(трифенилфосфин)родийхлорида]:
Д. широко применяют для получения дейтеросодержащих соед., введения дейтериевой метки при изучении строения соед. спектральными методами, а также при исследовании механизмов реакций.
Лит.: Мэррей А., Уильямс Д. Л., Синтезы органических соединений с изотопами водорода, пер. с англ., М., 1961; Мищенко Г Л., Вацуро К. В., Синтетические методы органической химии, М., 1982.
А. Н. Кашин
