диазоуксусный эфир
ДИАЗОУКСУСНЫЙ ЭФИР (этиловый эфир диазоуксусной кислоты) N2CHCOOC2H5
мол. м. 114,1; желтая вязкая жидкость; т. пл. −22 °C, т. кип. 140–141 °C; d420 1,0921; nD20 1,4616; раств. в этаноле, диэтиловом эфире, бензоле, трудно — в воде. Д. э. широко используется в орг. синтезе; во мн. реакциях промежуточно образуются диазоний-катион +N2CH2COOC2H5 или этоксикарбонилкарбен :CHCOOC2H5. С галогеноводородными кислотами и галогенами Д.э. дает соотв. моно- и дигалогенуксусные эфиры, напр.:
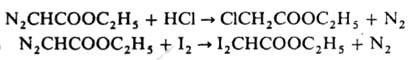
С водой, спиртами, карбоновыми кислотами реагирует по схеме:
N2CHCOOC2H5 + ROH → ROCH2COOC2H5 + N2
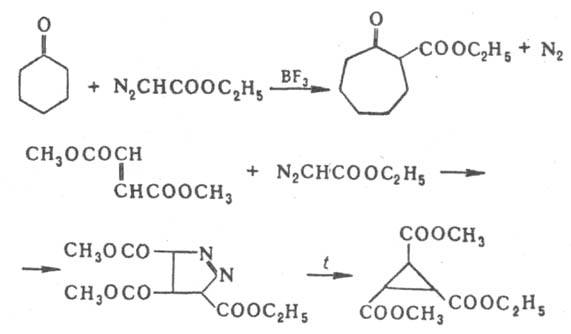
(R = H, Alk, Ac). Присоединение Д. э. по кратным связям и внедрение :CHCOOC2H5 по простым связям используется для расширения цикла ароматич. соединений и циклич. кетонов и получения производных циклопропана, напр.:
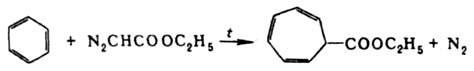
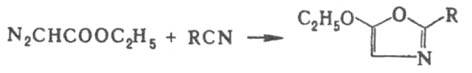
С нитрилами Д.э. дает оксазолы:
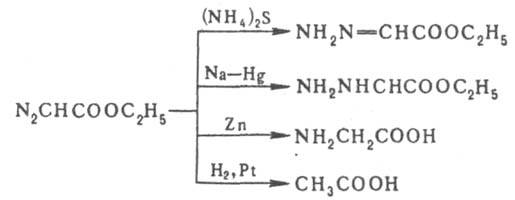
При взаимодействии с конц. NH3 образует глицин, аспарагиновую кислоту и их амиды. При нагр. с порошком Cu дает диэтилфумарат, а при обработке щелочью — производное сим-тетразина. Направление восстановления Д.э. зависит от используемого реагента:
Получают Д.э. реакцией гидрохлорида этилового эфира глицина с азотистой кислотой:
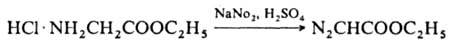
При действии конц. H2SO4 и HCl, а также при нагр. в недостаточно очищенном виде Д. э. разлагается со взрывом. Токсичен.
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 1, М., 1970, с. 249–50; Общая органическая химия, пер. с aнгл., т. 3, М., 1982,с. 306; там же, т. 4, М., 1983, с. 266.
И. В. Хвостов
Значения в других словарях
- Диазоуксусный эфир — Этиловый эфир диазоуксусной кислоты, N2CHCOOC2H5; жидкость жёлтого цвета со специфическим запахом; tпл — 24°С, tkип 143°C; плотность при 18°С 1,0852 г/см3, показатель преломления n18D 1,4588. Д. Большая советская энциклопедия
