Дикмана реакция
ДИКМАНА РЕАКЦИЯ (Дикмана конденсация)
внутримол. конденсация эфиров двухосновных кислот в циклич. β-кетоэфиры, напр.:
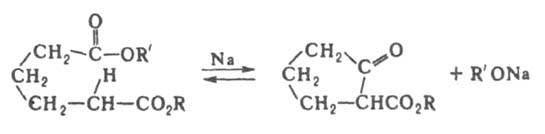
Д. р. — частный случай Клайзена конденсации (взаимод. двух молекул сложного эфира с образованием ациклич. кетоэфира). Осуществляется в присутствии оснований (щелочные металлы, их гидрооксиды, алкоголяты, амиды, гидриды, реже — трифенилметилнатрий, N-метиланилид лития и др.) в инертной атмосфере в среде эфира или ароматич. растворителей. Как правило, легко образуются 5- и 6-членные циклы; в условиях большего разбавления возможен синтез макроциклов. Присутствие алкильных групп в α- и β-положениях к карбоксильной группе препятствует циклизации, этоксикарбонильные группы в β-положении облегчают. Из двух возможных продуктов Д. р. образуется преимущественно продукт циклизации с участием метиленовой группы, обладающей более выраженными кислотными свойствами, напр.:
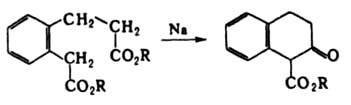
В орг. синтезах часто используется реакция, обратная Д. р., напр.:
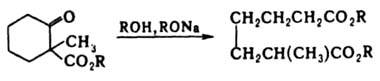
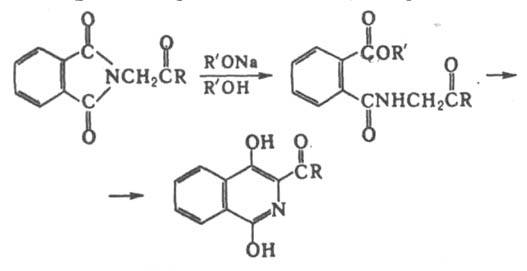
Д. р. применяется для получения алициклич., полициклич. и гетероциклич. соединений. Модификация Д. р. перегруппировка N-замещенных фталимидов или изатинов в производные изохинолина или хинолина (реакция Габриеля — Кольмана), напр.:
При использовании в качестве основания Na или NaOH наряду с продуктами Д. р. в больших количествах образуются циклич. ацилоины. Реакция открыта В. Дикманом в 1894. О получении макроциклич. кетонов циклизаций динитрилов см. Циглера реакции.
Лит.: Вульфсон Н. С., Зарецкий В. И., в кн.. Реакция и методы исследования органических соединений, кн. 12, М., 1963, с. 7–257.
Н. Г. Гамбарян
