Фаворского реакции
ФАВОРСКОГО РЕАКЦИИ
1) Перегруппировка a-галогенкетонов в карбоновые кислоты, их эфиры или амиды при действии оснований — соотв. щелочей, алкоголятов или аминов (наз. также перегруппировкой Фаворского):
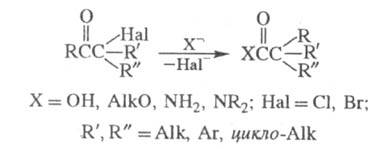
Обычно галогенкетон смешивают с конц. раствором основания (напр., в спирте) или с суспензией основания в растворителе (этаноле, эфире, толуоле) при температуре от −20 до +30 °C. Реакц. смесь выдерживают 10–30 мин (в случае низкореакционно-способных кетонов — 2–4 ч при нагр.). Выходы 30–70%.
В классич. варианте перегруппировки радикал R содержит атом H у α-атома С. В отсутствие α-H-атома реакция обычно идет в сравнительно жестких условиях (напр., при кипячении с NaOH в толуоле) и наз. квазиперегруппировкой Фаворского.
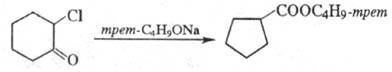
Перегруппировка циклич. кетонов протекает с сужением цикла, напр.:
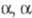 -Дигалогенкетоны и
-Дигалогенкетоны и 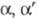 — дигалогенкетоны, содержащие α-H-атомы* в условиях Ф. р. образуют одну и ту же
— дигалогенкетоны, содержащие α-H-атомы* в условиях Ф. р. образуют одну и ту же 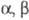 — ненасыщ. кислоту (или ее производное); тригалогенкетоны — галогензамещ. ненасыщ. кислоты, напр.:
— ненасыщ. кислоту (или ее производное); тригалогенкетоны — галогензамещ. ненасыщ. кислоты, напр.:
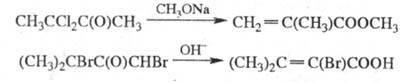
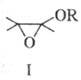
Осн. побочные продукты — эпоксиэфиры формулы I, образующиеся из них гидроксикетали и 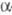 — гидроксикетоны, продукты расщепления связей С — С или замещения атома Hal на группы OH, OR или NR2, а также винилкетоны.
— гидроксикетоны, продукты расщепления связей С — С или замещения атома Hal на группы OH, OR или NR2, а также винилкетоны.
Механизм классич. перегруппировки включает образование на промежут. стадии циклопропанона (BH — основание):
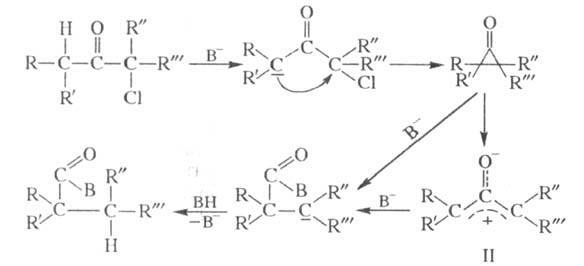
Циклопропаноны во мн. случаях (напр., при R, R: = трет-C4H9) удается выделить. Полученные др. способами циклопропаноны дают продукты перегруппировки при действии на них CH3ONa и др. сильных оснований.
Квазиперегруппировка Фаворского протекает по т. наз. семибензильному механизму:
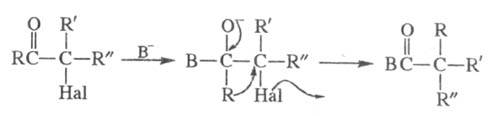
Известны случаи, когда семибензильный механизм реализуется и для кетонов с 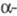 H-атомом (напр., для a-галогенциклобу-танонов). Видимо, в отдельных случаях в зависимости от условий может преобладать либо первый, либо второй механизм.
H-атомом (напр., для a-галогенциклобу-танонов). Видимо, в отдельных случаях в зависимости от условий может преобладать либо первый, либо второй механизм.
Оба механизма (за исключением варианта с образованием промежут. соед. II) предполагают обращение конфигурации при α-C-атоме, у которого мигрирующая группа замещает атом галогена.
Превращения, аналогичные этой перегруппировке, претерпевают под действием оснований амиды α-галогенкарбоновых кислот, 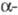 галогеналкилсульфамиды, α-галогеналкилсульфоны, α — гидроксикетоны и
галогеналкилсульфамиды, α-галогеналкилсульфоны, α — гидроксикетоны и 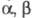 -эпоксикетоны, напр.:
-эпоксикетоны, напр.:
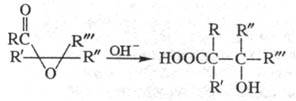
Реакцию используют в препаративной практике для получения циклич. кетонов и высокозамещ. (у α-С-атома) карбоновых кислот, в синтезе сложных прир. веществ (напр., стероидов).
Реакция открыта A. E. Фаворским в 1894.
Лит.: Кенде Э., в сб.: Органические реакции, пер. с англ., сб. 11, М., 1965, с. 267–326; Ахрем А. А. [и др.], "Успехи химии", 1970, т. 39, в. 9, с. 1560–90; Mарч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 1426.
2) Получение ацетиленовых спиртов присоединением ацетиленовых углеводородов к карбонильным соединениям в присутствии оснований:
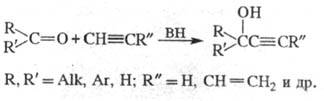
В реакцию вступают алициклич. кетоны и некоторые альдегиды. В ряду ацетиленов чаще используют незамещ. ацетилен и винилацетилен. Обычно реакцию проводят с суспензией KOH или NaNH2 в растворителе (эфире, бензоле, ДМФА и др.) при температуре от −70 до +40 С, давлении 0,4–0,9 МПа и большом избытке ацетилена (вместо ацетилена можно использовать CaC2 в присутствии KOH). Образовавшиеся алкоголяты обрабатывают H2O. Выходы 40–60%.
Осн. побочные продукты — смолы и ацетиленовые 1,4-ди-олы. Последние становятся осн. продуктом при использовании небольшого избытка ацетилена и температуре ок. 20 °C:
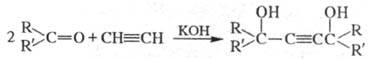
Считается, что механизм реакции включает образование ацетиленида, который присоединяется к карбонильному соед. с образованием алкоголята ацетиленового спирта.
Реакцию используют в синтезе виниловых спиртов, диенов, разл. алициклич. и гетероциклич. соединений.
Реакция открыта A. E. Фаворским в 1905.
Лит.: Котляревский И.Л., Швар цберг M. С., Фишер Л.Б., Реакции ацетиленовых соединений, Новосиб., 1967, с. 5–170; Михайловский Д.И. [и др.], "Ж. орган, химии", 1974, т. 10, в. 2, с. 188–91; Кондратьева Л. А. [и др.], там же, 1976, т. 12, в. 5, с. 940–44.
3) Изомеризация ацетиленовых углеводородов при нагр. в присуг. оснований:
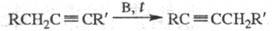
В = NaOH, KOH, Na, K2CO3
Направление реакции существенно зависит от условий и строения исходного ацетилена. Например, нагревание со спиртовой щелочью приводит к перемещению тройной связи в середину цепи, а нагревание с Na — к образованию ацетиле-нидов:
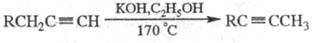
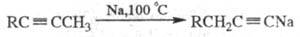
Наличие в молекуле Ar, R2N или группы COOH обычно облегчает изомеризацию (напр., достаточно использование K2CO3 при 40–90 °C или Na при 20 °C). Однозамещенные ацетилены с втор-алкильными радикалами изомеризуются в аллены (промежут. продукты Ф. р.; образуются во всех случаях в преобладающем количестве при понижении температуры реакции); соед. с трет-алкильными радикалами не изомеризуются.
Изомеризация — результат дважды реализующейся прото-тропной аллильной перегруппировки.
Перегруппировка открыта A. E. Фаворским в 1887.
Лит.: Темникова Т.Н., Курс теоретических основ органической химии, 2 изд., Л., 1962, с. 529–32; Wartanjan S. А., Badanjan S. О., "Angew. Chern.", 1963, Bd 75, S. 1034.
Г. И. Дрозд
