фенилфлуорон
ФЕНИЛФЛУОРОН (2,6,7-тригидрокси-9-фенил-3(3H)-ксантенон; формула I, R — фенил)
мол. м. 320,30; красно-оранжевые кристаллы, не раств. в воде, раств. в водно-спиртовых растворах кислот и щелочей, ДМФА. Амфотерен; pKa1 6,3, pKа2 10,2, pKa3 11,7; при pH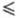 1,2 протонирован по карбонильной группе (pKа 2,1). В спектрах поглощения наблюдаются максимумы при следующих длинах волн λ (в нм): 462–465 (pH 1,2); 462 и 490–492 (pH 4,8–5,2); 512–514 (pH 8,4–9,0); 532–538 (pH 11,4–12,0); 556–558 (рН
1,2 протонирован по карбонильной группе (pKа 2,1). В спектрах поглощения наблюдаются максимумы при следующих длинах волн λ (в нм): 462–465 (pH 1,2); 462 и 490–492 (pH 4,8–5,2); 512–514 (pH 8,4–9,0); 532–538 (pH 11,4–12,0); 556–558 (рН 13,0). Получают Ф. конденсацией триацетоксигидрохинона (пирогаллола А) с бензальдегидом в водно-этанольной среде в присутствии H2SO4.
13,0). Получают Ф. конденсацией триацетоксигидрохинона (пирогаллола А) с бензальдегидом в водно-этанольной среде в присутствии H2SO4.
Ф. — реагент для фотометрич. определения в водно-этанольных растворах Ge(IV) (1M HCL, λ 530 нм, ε 4,0∙104), Sn(IV) (0,1М HCl, λ 530 нм, ε 3,5∙104), Ti(IV) (ρH 2–2,3, λ 540 нм, ε 7,4∙104), Sb(III) (0,05М H2SO4, λ 560 нм, ε 3,4∙104), Nb(V) (0,3М H2SO4, λ 510 нм, ε 3,1∙104), Mo(VI) (ρH 1, λ 578 нм, ε 4,9∙104). С ионами перечисленных металлов Ф. образует труднорастворимые в воде окрашенные комплексные соединения. В одно-этанольные растворы последних стабилизируют защитными коллоидами (желатин, гуммиарабик, поливиниловый спирт). Чувствительность определения увеличивается (ε достигает 105 и выше) при введении в эти растворы ПАВ. Ф. — неселективный реагент, поэтому обычно либо предварительно отделяют определяемый элемент, либо применяют маскирующие агенты.
Ф. — типичный представитель тригидроксифлуоронов (ок-сиксантеновых красителей) — соединений общей формулы I. Они представляют собой красные кристаллы, плавятся с разложением; не раств. в воде, этаноле, раств. в водно-спиртовых растворах кислот и щелочей. Слабые кислоты; в водно-спиртовых растворах в зависимости от pH образуют 5 различно окрашенных форм. Аналоги Ф.: салицилфлуорон (I, R — 2-гидроксифенил), про-пилфлуорон (1, R — пропил), 2-нитрофенилфлуорон (I, R -2-нитрофенил), 2,4-дисульфофенилфлуорон (I, R — 2,4-дису-льфофенил). Применяются для фотометрич. определения Ti(IV), Zr(IV), Hf(IV), Sn(IV), V(IV), Nb(V), Ta(V), Bi(III), Mo(VI), W(VI), с которыми образуют комплексные соединения, стабилизированные в водных растворах защитными коллоидами и ПАВ. Часто перечисленные металлы определяют в виде экстрагированных хлороформом разнолигандных комплексных соед., лигандами в которых кроме тригидроксифлуорона являются антипирин, диантипирилметан, N-бензоил-N-фенилгидроксиламин и его аналоги. Тригидроксифлуороны используют также для отделения, концентрирования (соосажде-нием) и последующего атомно-эмиссионного и рентгенофлуо-ресцентного определения микроколичеств Ge, РЗЭ, Ta, Nb, Zr, Hf, Bi, W и др.
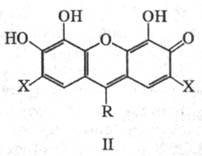
К тригидроксифлуоронам относят также соед. общей формулы II, обладающие аналогичными свойствами. Важнейшие представители: галлеин (II, X = H, R — 2-карбоксифенил), пирогалловый красный (П, X = H, R- 2-сульфофенил) и бромпирогалловый красный (II, X = Br, R — 2-сульфофенил). Они применяются в качестве комплексонометрич. индикаторов и для фотометрич. определения Ag(I), РЗЭ, Zr(IV), Sn(IV), Mo(VI) и др. .
Лит.: Назаренко В. А., Антонович В.П., Триоксифлуороны, М., 1973; Антонович В.П. [и др.], "Ж. аналит. химии", 1984, т. 39, в. 7, с. 1157–76; Антонович В.П. [и др.], "Ж. неорг. химии", 1986, т. 31, в. 6, с. 1422–26.
В. П. Антонович
