ферментативный катализ
ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ)
ускорение биохим. реакций при участии белковых макромолекул, называемых ферментами (энзимами). Ф.к. — разновидность катализа, хотя термин "ферментация" (брожение) известен с давних времен, когда еще не было понятия хим. катализа.
Первое исследование Ф. к. как хим. процесса было выполнено К. Кирхгофом, который в 1814 продемонстрировал фер-ментативную конверсию крахмала в растворимые углеводы.
Заметный вклад в представление о природе Ф. к. внесли работы И. Берцелиуса и Э. Мичерлиха, которые включили ферментативные реакции в категорию хим. каталитич. процессов. В кон. 19 в. Э. Фишер высказал гипотезу о специфичности ферментативных реакций и тесном стерич. соответствии между субстратом и активным центром фермента. Основы кинетики ферментативных реакций были заложены в работах Л. Михаэ-лиса (1913).
В 20 в. происходит интенсивное изучение хим. основ Ф. к., получение ферментов в кристаллич. состоянии, изучение структуры белковых молекул и их активных центров, исследование большого числа конкретных ферментативных реакций и ферментов.
В простейшем случае уравнение реакции с участием фермента имеет вид:
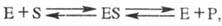
где E — фермент, S — субстрат, ES — фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт реакции.
Превращение субстрата в продукт происходит в комплексе Михаэлиса. Часто субстрат образует ковалентные связи с функциональными группами активного центра, в т. ч. и с группами кофермента (см. коферменты). Большое значение в механизмах ферментативных реакций имеет основной и кислотный катализ, реализуемый благодаря наличию имидазольных групп остатков гистидина и карбоксильных групп дикарбоновых аминокислот.
Важнейшие особенности Ф. к. — эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость хим. превращения субстрата по сравнению с неферментативной реакцией в 109–1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен (см. комплементарность) переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активац. барьер реакции.
Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или неск. близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т. ч. благодаря образованию изоферментов, которые катализируют идентичные реакции, но отличаются строением и каталитич. свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последоват. превращений вещества (см. регуляторы ферментов).
Ферментативные реакции чувствительны к внеш. условиям, в частности к ионной силе раствора и pH среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для хим. реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Максимум кривой соответствует оптимальной температуре Tопт, значение которой для большинства ферментов лежит в пределах 40–50 °C. Для некоторых ферментов, особенно ферментов термофильных микроорганизмов, Tопт 80–90 °C. Подробнее о кинетике ферментативных реакций см. ферментативных реакций кинетика.
Осн. направления совр. исследований Ф.к. — выяснение механизма, обусловливающего высокие скорости процессов, высокую селективность (специфичность действия ферментов), изучение механизмов контроля и регуляции активности ферментов. Оказалось, в частности, что реакции Ф. к. включают большое число стадий с участием лабильных промежут. соед., времена жизни которых изменяются в нано- и миллисекундном диапазонах. На активных центрах ферментов протекают быстрые (нелимитирующие) стадии, в результате чего понижается энергетич. барьер для наиб. трудной, лимитирующей стадии.
Установлен механизм регулирования ферментативной активности путем действия ингибитора (или активатора) на специфичный центр белковой молекулы с опосредованной передачей воздействия на активный центр фермента через белок. Обнаружены эффекты кооперативного взаимод. неск. молекул субстрата на белковой матрице. Найден способ "жесткого" выведения фермента из процесса посредством индуцированной субстратом необратимой инактивации.
Ф. к. — основа мн. современных хим. технологий, в частности крупномасштабных процессов получения глюкозы и фруктозы, антибиотиков, аминокислот, витаминов и регуляторов, а также тонкого орг. синтеза. Разработаны методы, позволяющие проводить ферментативные реакции в органических растворителях, обращенных мицеллах (см. мицеллообразование). С Ф.к. связаны перспективы развития иммуноферментного и биолюминесцентного анализа, применения биосенсоров. Созданы методы, позволившие придать каталитич. активность антителам, обнаружена каталитич. активность у рибонуклеи-новой кислоты (абзимы, рибозимы соотв.).
Лит.: Б е ρ е з и н И. В., Исследования в области ферментативного катализа и инженерной этимологии, М., 1990. См. также лит. к ст. Биотехнология^ Генетическая инженерия, Ферментативных реакций кинетика, Ферменты.
С. Д. Варфоломеев
Значения в других словарях
- Ферментативный катализ — Биокатализ, ускорение химических реакций под влиянием ферментов (См. Ферменты). В основе жизнедеятельности лежат многочисленные химические реакции расщепления питательных веществ... Большая советская энциклопедия
- ферментативный катализ — (биокатализ), ускорение химических реакций в клетках организма специальными белками – ферментами. Ферментативный катализ отличается чрезвычайно высокой эффективностью – реакции ускоряются в десятки и сотни тысяч (вплоть до миллионов и миллиардов) раз. Биология. Современная энциклопедия
- ферментативный катализ — Биокатализ, избирательное ускорение химич. реакций, протекающих в живом организме, под влиянием ферментов. Основан на снижении энергетич. барьера (т. н. энергии активации) за счёт образования промежуточных комплексов фермента с субстратом. Биологический энциклопедический словарь
- ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ — ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ) — ускорение химических реакций в живых клетках специальными белками — ферментами. В основе ферментативного катализа лежат те же химические закономерности, что и в основе небиологического катализа... Большой энциклопедический словарь
