галогены
ГАЛОГЕНЫ (галоиды) (от греч. hals, род. падеж halos — соль и — genes — рождающий, рождённый)
хим. элементы главной подгруппы VII гр. периодической системы: фтор, хлор, бром, иод и астат. Молекулы двухатомны. Внеш. электронная оболочка атомов имеет конфигурацию s2p5. С увеличением ат. массы Г. возрастают их ионный и ковалентный радиусы, уменьшаются энергии ионизации и электроотрицательность (см. табл.).
ХАРАКТЕРИСТИКА ГАЛОГЕНОВ
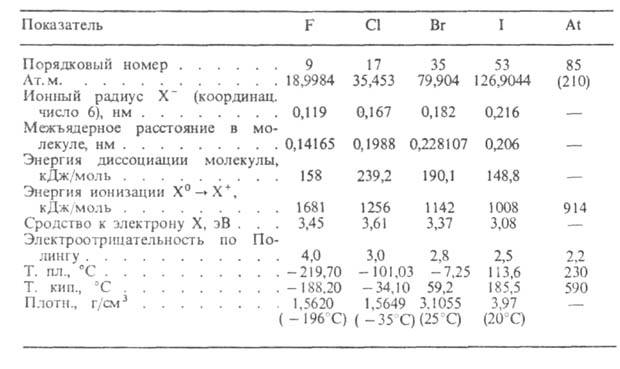
Г. характеризуются наибольшими среди всех элементов значениями сродства к .электрону. Наиб. электроотрицателен фтор. Сродство атомов Г. к электрону и энергия диссоциации молекул возрастают от фтора к хлору, а затем уменьшаются к иоду.
Степени окисления Г.: −1 (наиб. характерная); + 1 (НОF, НХО и др.); + 3 у С1 и Br (НХO2, XF3); + 4 у С1, Br, I (ХO2); + 5 (НХO3, XF5 и др.); + 6 у С1 (Cl2Oб); + 7 у С1, Br и I (HClO4, C12O7, HBrO4, IF7 и др.).
При обычных условиях F2 и Cl2-газы, Br2-жидкость, I2 и At2- твердые вещества. С увеличением ат. массы окраска Г. становится более интенсивной — от бледно-желтой у фтора до темно-красной у брома и темно-фиолетовой у иода. В твердом состоянии Г. образуют молекулярные кристаллы. Жидкие Г. — диэлектрики. Все Г., кроме фтора, раств. в воде; иод раств. хуже, чем хлор и бром; F2 окисляет воду до O2, O3 и фторидов кислорода. В водных растворах Cl2 и Br2 образуют гидраты Х2*nH2O и гипогалогенитионы ОХ− ; Br2 и I2 хорошо раств. в CHCl3, CS2, этаноле и др. органических растворителях.
Невысокие энергии диссоциации молекул Г. (существенно меньшие, чем у O2, H2 и N2) и большое сродство атомов к электрону определяют их высокую реакц. способность. Г. — сильные окислители. Наиб. активен фтор, образующий соед. со всеми хим. элементами, кроме Не, Ne и Ar. Реакц. способность Г. убывает с увеличением ат. массы и обычно возрастает в присутствии влаги и других Г. Водород с Г. образует галогеноводороды НХ. Энтальпии их образования очень мало зависят от температуры и уменьшаются от HF к HI. Термич. устойчивость в этом ряду также уменьшается. Растворы HCl, HBr и HI в воде — сильные кислоты, раствор HF-кислота средней силы.
• см. также бромистый водород, иодистый водород, соляная кислота, фтористый водород
С металлами и неметаллами Г. образуют галогениды, друг с другом-межгалогенные соединения. С кислородом Cl2, Br2 и I2 дают оксиды, F2-фториды кислорода. Все Г. (кроме фтора) образуют неустойчивые кислородсодержащие кислоты НХО, НХO2, НХO3 и НХО4; их кислотные свойства в указанном ряду усиливаются, а окислит. активность убывает. Особые группы соед. — гидрогалогениды (среди которых наиб. устойчивы гидрофториды металлов), напр. М H2Х3, и полигалогениды, напр. K[C1F2].
Фтор вытесняет хлор из его соед. с более электроположит. элементами, хлор вытесняет бром, а бром-иод (1/2 F2 + Cl− → F− + 1/2C12). С др. стороны, иод вытесняет бром и хлор из кислородсодержащих кислот и их солей, в которых Г. заряжены положительно (1/2I2 + [СIO3]− → [IO3]− + 1/2Cl2). Высшие степени окисления мн. хим. элементов стабилизируются фтором. Известны, напр., NiF3, AuF5, ReF7, криптона дифторид, ксенона фториды, соединения, содержащие в молекуле катион NF+4, анион FeFg62−, CoFg62−. Г. взаимод. со многими орг. соед., замещая атомы Н, присоединяясь по кратным связям или разлагая орг. вещества до галогенопроизводных метана. Мн. углеводороды горят или взрываются в атмосфере F2.
Ионы Г. в виде лигандов входят в состав молекул многочисленных комплексных соед., фтор и хлор участвуют в образовании мостиковых связей, напр. в Al2Clб, Ta4F20. Наиб. активны атомарные и ионизированные Г., которые получают в плазме, газовых разрядах или термокаталитич. разложением молекул Х2 и используют для синтеза термически нестойких галогенидов или ионного травления поверхностей металлов, полупроводниковых материалов.
Г. (за исключением астата) широко распространены в природе; они входят в состав мн. минералов, содержатся в морской воде; в своб. виде не встречаются. Все Г. ядовиты и обладают бактерицидными свойствами.
Соединения, напоминающие по химическим свойствам Г., напр. дициан (CN)2, диоксоциан (CON)2, дитиоциан (SCN)2, наз. псевдогалогенами, а соли металлов, содержащие группы CN, CON, SСN,-псевдогалогенидами.
Э. Г. Раков
Значения в других словарях
- галогены — -ов, мн. (ед. галоген, -а, м.). Группа химических элементов (фтор, хлор, бром, йод и др.), дающих при соединении с металлами соли. [От греч. ‛άλς, ‛αλός — соль и γένος — род, происхождение] Малый академический словарь
- Галогены — (от греч. hals — соль и... genes — рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы... Большая советская энциклопедия
- галогены — орф. галогены, -ов, ед. -ген, -а (хим.) Орфографический словарь Лопатина
- ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Научно-технический словарь
- галогены — ГАЛОГЕНЫ -ов; мн. (ед. галоген, -а; м.). [от греч. hals — соль и genesis — род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, -ая, -ое. Г-ые соединения. Толковый словарь Кузнецова
- галогены — [гало… + гр. род, происхождение] – группа химических элементов (фтор, хлор, бром, йод); встречается в природе исключительно в виде солей; имеет большое практическое применение Большой словарь иностранных слов
- галогены — галогены мн. Группа сходных по свойствам химических элементов (фтор, хлор, бром, йод и астат), образующих соли при соединении с металлами и широко используемые в практике. Толковый словарь Ефремовой
- ГАЛОГЕНЫ — ГАЛОГЕНЫ (устар. выражение галоиды) — химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Большой энциклопедический словарь
