гексафторацетон
ГЕКСАФТОРАЦЕТОН (перфторацетон) CF3COCF3
мол. м. 166,03; бесцветный газ с резким запахом; т. пл. −122 °C, т. кип. −27,28 °C; плотность жидкости 1,318 г/см3 (25 °C); 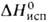 21,61 кДж/моль ( −27,28 °C); потенциал ионизации 11,68 эВ; умеренно раств. в апротонных органических растворителях; реагирует с водой и спиртами; разлагается на CO и CF3 лишь при 550 °C или УФ-облучении. Типичный представитель полифторкетонов. В реакциях с нуклеоф. агентами Г. гораздо активнее, чем нефториров. кетоны. Иногда вступает в превращения, не свойственные алифатич. кетонам, в частности легко образует устойчивые аддукты (CF3)2C(OH)X, где X = OH, OR, NR2. С фторидами щелочных металлов дает относительно стабильный анион (CF3)2CFO−, широко используемый в синтезах. Легко восстанавливается третичными аминами до (CF3)2CHOH, реагирует с соед., содержащими активные метиленовые группы, и олефинами, напр.:
21,61 кДж/моль ( −27,28 °C); потенциал ионизации 11,68 эВ; умеренно раств. в апротонных органических растворителях; реагирует с водой и спиртами; разлагается на CO и CF3 лишь при 550 °C или УФ-облучении. Типичный представитель полифторкетонов. В реакциях с нуклеоф. агентами Г. гораздо активнее, чем нефториров. кетоны. Иногда вступает в превращения, не свойственные алифатич. кетонам, в частности легко образует устойчивые аддукты (CF3)2C(OH)X, где X = OH, OR, NR2. С фторидами щелочных металлов дает относительно стабильный анион (CF3)2CFO−, широко используемый в синтезах. Легко восстанавливается третичными аминами до (CF3)2CHOH, реагирует с соед., содержащими активные метиленовые группы, и олефинами, напр.:
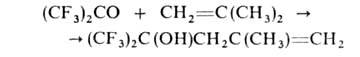
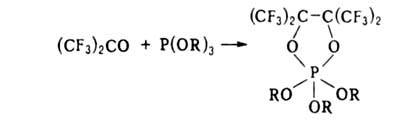
С диенами, кетенами, алкоксиацетиленами, изонитрилами, соединениями Р(Ш) образует продукты циклоприсоединения, напр.:
По отношению к электроф. агентам Г. крайне пассивен: не протонируется сильными кислотами, лишь при 100 °C взаимод. с фенолом в безводном HF, образуя гексафтордифенилолпропан.
Пром. способ получения Г.: реакция (CCl3)2СО с HF в присутствии солей Cr(IП). Др. способы: окисление перфторизобутилена или тиогексафторацетона, изомеризация гексафторпропиленоксида. Применяют Г. в синтезе гексафторизопропилового спирта, фторорганических мономеров, сополимеров Г. с олефинами и их оксидами, лекарственных средств.
Летальная концентрация 0,09% по объему (крысы, экспозиция 30 мин).
Гексафторацетон впервые получен Н. Фукухарой и С.Л. Бигелоу в 1941.
Гидрат Г. (CF3)2C(OH)2-гигроскопичные белые кристаллы; т. пл. 49 °C; pKа 6,58. При действии конц. H2SO4 дает Г., на воздухе превращ. в жидкий сесквигидрат-хороший растворитель полимеров, напр. полиамидов, сложных полиэфиров, полиформальдегида. ЛД50 190 мг/кг (крысы, перорально).
Лит.: Gambaryan N. P. [u.a.], "Angew. Chem.", 1966, Bd 78, № 22, S. 1008–17.
Н. П. Гамбарян
