хинолиновые алкалоиды
ХИНОЛИНОВЫЕ АЛКАЛОИДЫ
содержат в молекуле остаток хинолина или некоторых его производных. Включают более 300 представителей. Выделены из растений 14 семейств, а также некоторых микроорганизмов и животных. Наиб. богатые ими растения семейства рутовых (Rutaceae), мареновых (Rubiaceae), парнолистниковых (Zygophyliaceae) и сложноцветных (Compositae).
Различают след. основные группы Х. а.: 1) простые хинолины (общая формула I; R = Н, OCH3, R' = алкил, арил), 4-хинолоны (II; R = Н, CH3, R' = Н, алкил, арил) и 2-хинолоны (III; R = Н, CH3, R' = Н, алкил, алкенил); 2) гемитерпеноидные и терпеноидные трициклич. производные типов IV-Х; З) фуранохинолины, к которым относятся, в частности, производные диктамнина (XI; R = OCH3) и соед. типа ХII; 4) димерные алкалоиды, напр. ХIII. К Х. а. иногда относят также соед., содержащие кроме хинолина остатки хинуклидина (в частности, хинин), 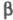 -карболина (как в XIV) и др.; однако чаще их выделяют в отдельный класс алкалоидов, специфичный для растений определенных родов, напр. хинного дерева (Cinchona), селитрянки (Nitraria).
-карболина (как в XIV) и др.; однако чаще их выделяют в отдельный класс алкалоидов, специфичный для растений определенных родов, напр. хинного дерева (Cinchona), селитрянки (Nitraria).
Каждой группе алкалоидов присущи характерные хим. и спектральные свойства. Общие свойства Л. а., содержащих в положениях 2 или 4 метоксигруппу: а) способность изомеризоваться при нагр. с CH3I в N-метил-2(или 4)-хинолоны (напр., IV изомеризуется в V, VI — в VII); б) легкость гидролиза (дементирования) в щелочной или кислой среде, напр., XI (R = OCH3)  XI (R=OH). Природные и синтетич. четвертичные Х. а. при пиролизе или нагревании с безводным пиридином превращаются в соответствующие третичные основания, напр. соединение XV в IV.
XI (R=OH). Природные и синтетич. четвертичные Х. а. при пиролизе или нагревании с безводным пиридином превращаются в соответствующие третичные основания, напр. соединение XV в IV.
2-Хинолоны, напр., 4-метокси-3-пренил-2-хинолон [III; R = CH3, R' = CH2СН = С(CH3)2] при нагр. с конц. HCl или HBr в ледяной CH3COOH образует трициклические Х. а. типа VII и IX.
Характерная реакция фуранохинолиновых алкалоидов (XI) — гидрогенолиз фуранового кольца с образованием З-этил-2-хинолоновых производных (III; R = CH3, R' = C2H5).
Для исследования структуры Х. а. используют спектральные методы. По значению максимумов поглощения в ЙК и УФ спектрах и характеру их смещения в зависимости от pH среды различают не только группы Х. а., но и иногда положения заместителей. Масс-спектрометрия позволяет установить принадлежность алкалоида к определенной группе и различать такие близкие изомеры, как V и VII; VIII и IX. По положению и интегральной интенсивности полосы поглощения в области 1610–1665 см−1 ИК спектра можно различить 2- и 4-хинолоны, а также изомерные соединения V и VIII, VII и IX. В большинстве случаев о полной структуре Х. а. можно судить по данным спектров ЯМР 1Н и 13С.
Различные Х. а. имеют разных биогенетич. предшественников. Так биосинтез хинина и производных кинуреновой кислоты (I; R = OH, R' = СООН) осуществляется из триптофана, а Х. а. семейства рутовых (соед. I-ХIII, XV) — из антраниловой кислоты.
Х. а. обладают широким спектром физиологич. активности. Большинство алкалоидов оказывает успокаивающее действие на центр. нервную систему: некоторые из них, напр. флиндерсин (X), проявляют антифидантные свойства. В медицине применяется хинин и эхинопсин (II; R = CH3, R' = Н) как стимулятор центр. и периферич. нервной системы.
Лит.: Садритдинов Ф. С., Курмуков А. Г., Фармакологах растительных алкалоидов и их применение в медицине, Таш., 1980; Беесонова И. А., Юнусов С. Ю., "Химия прир. соед.", 1989, № 1, с. 4–18; Маnske R.H.E, Rodrigо R., в кн.: The Alkaloids, v. 17. N. Y., 1979, p. 105–200.
И. А. Бессонова
