хлора оксиды
ХЛОРА ОКСИДЫ
Все Х. о. имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду, имеют положит.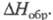 Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
Монооксид [оксид С1(I), дихлороксид, гемиоксид] Cl2O — желто-оранжевый газ со слабым зеленоватым оттенком, в жидком состоянии — красно-коричневый; длина связи С1 — О 0,1700 нм, угол OClO 111°, μ 2,60∙10−30 Кл∙м (табл.); уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,87 — 1373/Т (173–288 К); раств. в воде с образованием HClO, растворимость (г в 100 г H2O при 0 °C): 33,6 (2,66 кПа), 52,4 (6,65 кПа). При 60–100 °C термич. распад Cl2O завершается за 12–24 ч, выше 110 °C через неск. мин происходит взрыв, освещение ускоряет распад и повышает вероятность взрыва. С хлоридами образует оксихлориды, напр., с TlCl4, TaCl5 и AsCl3 дает соотв. Т1OCl2, TaOCl3 и AsO2Cl. С NO2 образует смесь NO2C1 и NO3C1, с N2O5 — чистый NO3C1. Фторированием Cl2O с помощью AgF2 можно получить C1OF3, а реакцией с AsF5 или SbF5 — соли хлорила ClO+2MF−6. Аналогично реагируют с MF5 (где М — As и Sb) ClO2 и Cl2O6. С насыщ. орг. соединениями Cl2O ведет себя как хлорирующий агент, подобный хлору. Получают Cl2O пропусканием Cl2, разбавленного N2, над HgO или реакцией Cl2 с влажным Na2CO3.
СВОЙСТВА ОКСИДОВ ХЛОРА
таблица в процессе добавления
* Расчетная. ** 2,38 г/см3 при −160 °C.
Диоксид ClO2 — желтый газ, в жидком состоянии — ярко-красный, в твердом — красновато-желтый; длина связи С — О 0,1475 нм, угол OClO 117 °C; уравнение температурной зависимости давления пара lgp (мм рт. ст.) = 7,7427 -- 1275,1/T (226–312 К); растворимость в воде 26,1 г/л (25 °C, 20,68 кПа), раств. в CCl4, HClO4, CH3COOH. В индивидуальном состоянии взрывоопасен, при 30–50 °C распад идет с измеримой скоростью, выше 50 С после периода индукции взрывается. В щелочной среде ClO2 диспропорционирует на и
и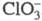 , в присутствии H2O2 образуется
, в присутствии H2O2 образуется и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
и выделяется O2. Восстанавливается иодидами, арсенидами, PbO, H2SO3, аминами до хлорит-иона. СNO2 и N2O5 образует NO3C1, с NOC1 -NO2C1. Фторируется посредством AgF2, BrF3 или разб. F2 до C1O2F. Получают ClO2 действием восстановителей (SO2, NO2, метанол, орг. пероксиды) на подкисленный раствор хлората щелочного металла, при нагр. смеси хлората с влажной щавелевой кислотой, действием Cl2 на хлориты. В отличие от остальных Х. о. ClO2 — продукт пром. производства, его используют вместо Cl2 как экологически более безопасный продукт для отбеливания древесной пульпы, целлюлозы, синтетич. волокон, для подготовки питьевой и технол. воды, обеззараживания сточных вод. Раздражает слизистые оболочки, вызывает кашель, рвоту и др.; ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 140 мг/кг (крысы, внутрижелудочно).
Перхлорат хлора (цихлоротетраоксид) Cl2O4, или ClOClO3 — светло-желтая жидкость, в кристаллич. состоянии почти бесцветен (см. перхлораты).
Триоксид (дихлорогексаоксид) Cl2O6 — ярко-красная жидкость, в твердом состоянии — оранжевый, при охлаждении окраска ослабевает. В газе и жидкости молекулы имеют строение O2Cl — О — ClO3, в кристаллах -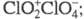 кристаллы моноклинной сингонии (пространств. группа
кристаллы моноклинной сингонии (пространств. группа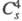 , z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
, z = 4); давление пара 39,9 Па (0 °C), 133 Па (19 °C). Медленно разлагается уже при 0–10 °C на ClO2 и O2, выше 20 °C в продуктах распада появляется Cl2; с водой реагирует со вспышкой, продукты гидролиза — HClO3 и HClO4. С хлоридами, бромидами, нитратами образует перхлораты, напр. с NOC1 дает NOC1O4, с N2O5 — NO2C1O4, с AlCl3 -ClO2[А1(ClO4)4], с FeCl3 — ClO2[Fe2(ClO4)7]. При нагр. в вакууме такие комплексы отщепляют Cl2O6 и превращаются в несольватированные перхлораты А1(ClO4)3, Fe(ClO4)3. Получают Cl2O6 реакцией озона с ClO2 или действием F2 на хлораты металлов. Применяют для синтеза безводных перхлоратов в лаб. условиях.
Оксид Cl(VII) (хлорный ангидрид, дихлорогептаоксид) Cl2O7 — бесцв. подвижная жидкость, чувствителен к удару и трению. Молекула имеет строение O3С1 — О — ClO3, длина связи С1 — О 0,1709 нм, в группах ClO3 — 0,1405 нм, угол ClOС1 118,6°, OClO 115,2°, μ 2,40∙10−30 Кл∙м; кристаллы моноклинные (пространств. группа C2/с); уравнение температурной зависимости давления пара lgp( мм рт. ст.) = 7,796-1770/Т. Неограниченно раств. в CCl4, хорошо раств. в HClO4, POCl3 и т. п. С водой не смешивается, на границе раздела фаз реагирует с образованием HClO4, реакция сильно экзотермична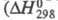 реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
реакции −211 кДж/моль); разогревание слоя Cl2O7 может привести к взрыву. Распад Cl2O7 в газе на хлор и кислород идет с измеримой скоростью при 100–120 °C, но при давлении Cl2O7 выше 13,3 кПа приобретает взрывной характер. Жидкий Cl2O7 устойчив до 60–70 °C, примесь низших Х. о. ускоряет его распад. Для жидкого Cl2O7 характерны реакции с образованием ковалентных соед. с группой — ClO3. С NH3 в CCl4 образует NH4HNC1O3 и NH4C1O4, с алкиламинами — соотв. RHNC1O3 и R2NC1O3, с SbF5 — SbOF3 и FC1O3, с N2O5 в CCl4 NO2C1O4. Используя Cl2O7, можно синтезировать орг. перхлораты из спиртов. Получают Cl2O7 действием P2O5 или олеума на хлорную кислоту или электролизом раствора HClO4 на Pt-электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно получить также при нагр. в вакууме некоторых перхлоратов, напр. Nb(ClO4)5, MoO2(ClO4)2.
Известен ряд хлоркислородных свободных радикалов, полученных в разл. низкотемпературных матрицах и исследованных преим. методом ЭПР,- ClO3, ClOO, ClClO, а также малостабильный сесквиоксид Cl2O3, распадающийся при −50 — 0 °C и имеющий, вероятно, структуру хлората хлора ClOClO2. Термически устойчивый радикал ClO (длина связи С1 — О 0,1569 нм, 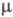 4,133 Кл∙м,
4,133 Кл∙м, 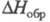 101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
101,6 кДж/ моль) — промежут. продукт окисления углеводородов хлорной кислотой и Х. о., распада всех Х. о. и др. хлоркислородных соед., а также реакции озона с атомарным хлором в стратосфере.
Лит.: Никитин И. В., Химия кислородных соединений галогенов, М., 1986.
В. Я. Росоловский
Значения в других словарях
- ХЛОРА ОКСИДЫ — ХЛОРА ОКСИДЫ: гемиоксид Cl2O (желто-коричневый газ) — диоксид ClO2 (зеленовато-желтый газ) — триоксид Cl2O6 (темно-коричневая жидкость) — хлорный ангидрид Cl2O7 (бесцветная жидкость). Сильные окислители, взрывоопасны. ClO2 — отбеливатель целлюлозы, тканей, бумаги. Большой энциклопедический словарь
