хлораль
ХЛОРАЛЬ (трихлорацетальдегид, трихлоруксусный альдегид) CCl3CHO
мол. м. 147,4; бесцветная жидкость с резким запахом; т. пл. −57,5 °C, т. кип. 97,75 °C; 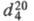 1,5121;
1,5121; 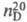 1,4557; давление пара (кПа) 0,13 ( −30 °C), 4,25 (20 °C), 108 (100 °C); μ 5,27∙10−30 Кл∙м; η (мПа∙с) 1,077 (22,5 °C), 0,533 (80 °C); γ 26,2 мН/м (50 °C);
1,4557; давление пара (кПа) 0,13 ( −30 °C), 4,25 (20 °C), 108 (100 °C); μ 5,27∙10−30 Кл∙м; η (мПа∙с) 1,077 (22,5 °C), 0,533 (80 °C); γ 26,2 мН/м (50 °C); 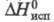 240,6 кДж/кг;
240,6 кДж/кг; 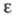 7,580 ( −40,1 °C), 4,228 (62,1 °C); раств. в органических растворителях; в воде не раств., но реагирует с ней с образованием водорастворимого хлораль-гидрата CCl3CH(OH)2, мол. м. 165,2; т. пл. 51,4 °C, т. кип. 97,5 С,
7,580 ( −40,1 °C), 4,228 (62,1 °C); раств. в органических растворителях; в воде не раств., но реагирует с ней с образованием водорастворимого хлораль-гидрата CCl3CH(OH)2, мол. м. 165,2; т. пл. 51,4 °C, т. кип. 97,5 С, 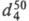 1,619; последний раств. в этаноле, диэтиловом эфире, слабо раств. в бензоле, сероуглероде.
1,619; последний раств. в этаноле, диэтиловом эфире, слабо раств. в бензоле, сероуглероде.
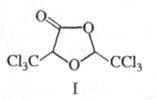
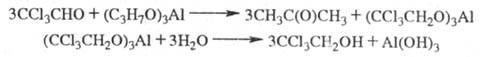
Х. вступает в реакции с др. нуклеофилами, давая твердые хорошо кристаллизующиеся устойчивые аддукты, напр. с NH3 — хлоральаммиак CCl3CH(OH)NH2, с алкоголятами — хлоральалкоголяты CCl3CH(OH)OR (полуацетали) или ацетали CCl3CH(OR)2. При кипячении водных растворов Х. образуется глиоксиловая кислота НC(O)COOH; при действии щелочей -CHCl3 и соль муравьиной кислоты; при нагр. с H2SO4 — хлоралид (формула I; т. пл. 116 °C). Конц. HNO3 окисляет Х. до CCl3COOH (с выделением NO и NO2); при действии восстановителей, напр., изопропилата алюминия, образуется трихлорэтанол:
Хлорирование Х. при температурах выше 100 °C или УФ освещении приводит к образованию CCl4, CO и HCl.
При хранении Х. медленно полимеризуется в белую аморфную массу (метахлораль, парахлораль), не раств. в воде, разбавленных кислотах, большинстве орг. растворителей. Скорость полимеризации резко возрастает в присутствии H2SO4, (CH3)3N, AlCl3 и др. катализаторов. При пиролизе (160–180 °C) полимер деполимеризуется с образованием мономерного X.
В промышленности Х. получают хлорированием этанола в каскаде двух реакторов: в первый реактор вводится хлор, частично прохлорированный спирт и вода, необходимая для гидролиза промежут. продуктов хлорирования, температура в реакторе (до 90 °C) поддерживается за счет теплоты реакции. Во втором реакторе реагирует непрореагировавший в первом хлор и свежий этанол. Техн. продукт содержит 80–85% хлоральгидрата, 10–15% хлоральалкоголята, примеси HCl и дихлорацетальдегида. Х. выделяют обработкой смеси конц. H2SO4 с послед. разделением слоев, перегонкой и ректификацией.
Х. может быть получен также хлорированием этиленхлоргидрина, ацетальдегида или смеси диэтилового эфира с водой при 25–90 °C, а также из CCl4 и CH2O при пропускании их паров над тонко раздробленными металлами (Cu) при 300 °C.
Используют Х. в осн. для производства инсектицидов и гербицидов, в небольших количествах для получения фармацевтич. препаратов. В виде хлоральгидрата ограниченно применялся как успокаивающее, снотворное и анестезирующее средство.
Х. — трудногорючая жидкость. ПДК в воде водоемов хозяйств.-бытового пользования 0,2 мг/л.
Лит.: Промышленные хлорорганические продукты. Справочник, под ред. Л. А. Ошина, М., 1978, с. 159–67.
Ю. А. Трегер
Значения в других словарях
- Хлораль — Трихлоруксусный альдегид, CCl3CHO, бесцветная жидкость с резким запахом, tkип 97,75 °С. Х. энергично взаимодействует с водой, спиртом, аммиаком, образуя хорошо кристаллизующиеся продукты (см. Хлоральгидрат). Большая советская энциклопедия
- хлораль — орф. хлораль, -я Орфографический словарь Лопатина
