хлорфеноксиуксусные кислоты
ХЛОРФЕНОКСИУКСУСНЫЕ КИСЛОТЫ (О-хлорфенилгликолевые кислоты)
соед. формулы I (n = 1–5). Наиб. пром. значение имеют 4-хлорфеноксиуксусная кислота (4-ХФУК, парафен, томато-фикс, томатон) и ее 2-метилпроизводное — 2-метил-4-хлорфеноксиуксусная кислота (2М-4Х, МСРА, дикотекс, метаксон), а также 2,4-дихлорфеноксиуксусная (2,4-Д, акваклин) и 2,4,5-трихлорфеноксиуксусная (2,4,5-Т) кислоты (табл.).
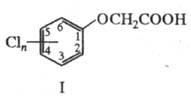
Х. к. — слабые кислоты; обладают свойствами карбоновых кислот и ароматических соединений. Легко образуют соли, ангидриды, хлорангидриды, эфиры, амиды и др. производные. С ароматич. альдегидами вступают в реакцию Перкина с образованием производных коричной кислоты, напр.:
СВОЙСТВА ОСНОВНЫХ ХЛОРФЕНОКСИУКСУСНЫХ КИСЛОТ
таблица в процессе добавления
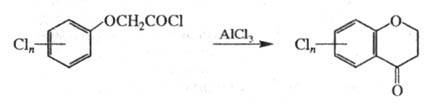
При хлорировании получаются продукты более глубокого хлорирования, напр. 2,4-Д при взаимодействии с Cl2 превращается в 2,4,6-трихлорфеноксиуксусную кислоту. Нитрование 2,4-Д приводит гл. обр. к 5-нитро-2,4-дихлорфеноксиуксусной кислоте (примесь — 6-нитроизомер). При нагр. Х. к. с HHal происходит гидролиз с образованием соответствующего хлорфенола и гликолевой кислоты; реакция быстрее всего протекает с HI и идет тем легче, чем выше кислотность образующегося фенола. Действие AlCl3 на хлорангидриды Х. к. приводит к образованию производных 4-хроманона:
Наиболее распространенный пром. способ получения Х. к. заключается в конденсации хлорфенолятов с солями монохлоруксусной кислоты в водной или орг. среде, напр:
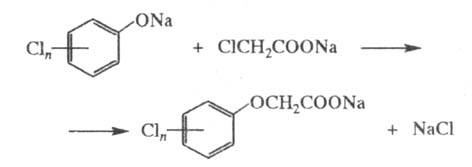
Для уменьшения гидролиза продукта реакцию в водной среде проводят в избытке фенолята или с добавлением NaCl. При проведении процесса возможно образование высокотоксичных производных диоксина, напр. при синтезе 2,4,5-Т образуется 2,3,7,8-тетрахлордибензодиоксин (ЛД100 Для животных 0,08–0,2 мг/кг):
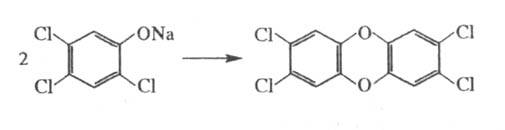
Производство 2,4,5-Т этим способом постепенно сокращается.
Другой пром. метод получения — хлорирование феноксиуксусной кислоты, полученной конденсацией фенолята Na с хлорацетатом Na в водной среде, или ее производных (в частности, эфиров) действием Cl2, NaCIO, смесью NaClO3 с HCl, сульфурилхлорида или хлорамина. Наиб. распространен метод прямого хлорирования; реакцию проводят в расплаве кислоты, органическом растворителе, в присутствии катализаторов (I2, Fe-стружки) или водно-щелочной среде с эквимолярным количеством Cl2 при повышенной температуре. Например, эфиры 2,4-Д получают взаимод. Cl2 с эфирами феноксиуксусной кислоты при 150 °C:
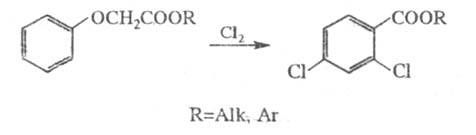
2,4,5-Т получают хлорированием 2,5-дихлорфеноксиуксусной кислоты в органическом растворителе при 90–120 °C.
Все Х. к. и их производные (ангидриды, хлорангидриды, эфиры, амиды и др.) — биологически активные вещества — гл. обр. гербициды и регуляторы роста растений, а также бактерициды, фунгициды, репелленты, овициды. Широко используются для борьбы с двудольными сорняками в посевах хлебных злаков и техн. культур (2,4-Д, 2М-4Х в дозах 0,2–2 кг/га), с кустарниками и древесной порослью (2,4,5-Т в дозах 5–7 кг/га применяют обычно в виде бутилового эфира в смеси с бутиловым эфиром 2,4-Д); 4-ХФУК — регулятор роста растений для получения паргенокарпич. плодов томатов. Наиб. сильным гербицидным действием обладают эфиры Х. к., причем для достижения равного с действием кислоты эффекта требуется в 2–3 раза меньшая доза препарата. ПДК в воздухе рабочей зоны для 2М-4Х и 2,4-Д −1,0 мг/м3.
Общий объем производства Х. к. и их производных в России ок. 50 тыс. т в год (1990); более 1/2 объема приходится на эфиры Х. к. (ок. 1500 препаратов).
Лит.: Мельниковы. Н., Пестициды. Химия, технология и применение, М., 1987; Каспаров В. А., Промоненков В. К., Применение пестицидов за рубежом, М., 1990.
А. А. Заликин
