хром
ХРОМ (от греч. chroma — цвет, краска; из-за яркой окраски соед.; лат. Chromium) Cr
хим. элемент VI гр. периодической системы, ат. н. 24, ат. м. 51,9961. Природный Х. состоит из смеси 4 изотопов 50Cr (4,35%), 52Cr (83,79%), 53Cr (9,50%) и 54Cr (2,36%). Поперечное сечение захвата тепловых нейтронов для Х. 3,1∙10−28 м2.
Конфигурация внеш. электронных оболочек атома 3d54s1; степени окисления +2, +3, +6, реже +4, +5 и +1; энергия ионизации при переходе от Cr0 к Cr6+ 6,766, 16,49, 30,96, 49,1, 69,3 и 90,6 эВ; сродство к электрону 1,6 эВ; электроотрицательность по Полингу 1,66; атомный радиус 0,127 нм, ионные радиусы, в нм (в скобках указаны координац. числа): для Cr2+ 0,073 (6), Cr3+ 0,0615 (6), Cr4+ 0,041 (4), 0,055 (6), Cr5+ 0,0345 (4), 0,049 (6) и 0,057 (8), для Cr6+ 0,026 (4) и 0,044 (6).
Содержание Х. в земной коре 0,035% по массе, в воде морей и океанов 2∙10−5 мг/л. Известно более 40 минералов X., из них для извлечения Х. используют только хромит FeCr2O4, точнее хромшпинелиды (Mg, Fe)(Cr, Al, Fe)2O4. Некоторые др. минералы: крокоит PbCrO4, волконскоит Cr2Si4O10(OH)2 xnH2O, уваровит Ca3Cr2(SiO4)3, вокеленит Pb2Cu[CrO4]PO4, феникохроит Pb3O(CrO4)2. Сульфидные минералы Х. обнаружены в метеоритах.
Свойства. X. — голубовато-белый металл. Кристаллич. решетка объемноцентрированная кубич. а = 0,28845 нм, z = 2, пространственная группа 1тЗт. При 312 К (точка Нееля) переходит из парамагнитного в антиферромагнитное состояние. Еще один переход (без изменения структуры) фиксируется при 170–220 К. Т. пл. 1890 °C, т. кип. 2680 °C; плотн. 7,19 г/см3; 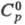 23,3 Дж/(моль∙К);
23,3 Дж/(моль∙К); 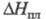 21 кДж/моль,
21 кДж/моль,  338 кДж/моль;
338 кДж/моль; 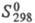 23,6 Дж/(моль∙К); уравнения температурной зависимости давления пара для твердого X. lgp (мм рт. ст.) = = 11,454 — 22598/T — 0,406 lgT + 0,781T (298 — 2163 К), для жидкого X. lgp (мм рт. ст.) = 9,446 — 18204/T+ 0,114 lg Т (2163 — 2950 К); температурный коэф. линейного расширения 4,1∙10−6 К−1; теплопроводность 88,6 Вт/(м∙К); р 0,15∙10−6 Ом∙м, температурный козф.
23,6 Дж/(моль∙К); уравнения температурной зависимости давления пара для твердого X. lgp (мм рт. ст.) = = 11,454 — 22598/T — 0,406 lgT + 0,781T (298 — 2163 К), для жидкого X. lgp (мм рт. ст.) = 9,446 — 18204/T+ 0,114 lg Т (2163 — 2950 К); температурный коэф. линейного расширения 4,1∙10−6 К−1; теплопроводность 88,6 Вт/(м∙К); р 0,15∙10−6 Ом∙м, температурный козф.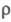 3,01∙10−3 К−1. Парамагнитен, магн. восприимчивость +3,49∙109. Модуль нормальной упругости (для отожженного Х. высокой чистоты) 288,1 ГПа;
3,01∙10−3 К−1. Парамагнитен, магн. восприимчивость +3,49∙109. Модуль нормальной упругости (для отожженного Х. высокой чистоты) 288,1 ГПа; 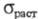 410 МПа; относит. удлинение 44%; твердость по Бринеллю 1060 МПа. Х. техн. чистоты хрупок, приобретает пластичность выше 200–250 °C.
410 МПа; относит. удлинение 44%; твердость по Бринеллю 1060 МПа. Х. техн. чистоты хрупок, приобретает пластичность выше 200–250 °C.
Стандартный электродный потенциал −0,74 В (относительно раствора Cr3+). Х. устойчив на воздухе (однако тонкоизмельченный пирофорен) и к действию воды. Нагретый в кислороде до ~ 300 °C сгорает с образованием Cr2O3 (см. хрома оксиды). Раств. в соляной и разб. серной кислотах. В конц. HNO3, HClO4, H3PO4 и под действием окислителей легко пассивируется. Пассивный Х. очень устойчив. Растворы щелочей на Х. не действуют, расплавленные щелочи в отсутствие воздуха очень медленно реагируют с выделением H2.
Фтор действует на Х. выше 350 °C. Сухой хлор начинает реагировать с л. выше 300 °C, влажный хлор начинает действовать уже с 80 °C. Бром и иод действуют на Х. при температуре красного каления, также как HF и HCl.
• см. хрома галогениды
С водородом Х. непосредственно не взаимодействует. Растворимость H2 в Х. 0,44 ат. % при 800 °C, но электролитич. X.
может содержать значительно большие количества — до 300 объемов на объем металла. Путем электролиза можно получить и гидриды- CrН с гексагон. решеткой и кубич. гидрид, чей состав приближается к CrH2. Эти металлоподобные гидриды при нагр. легко теряют водород.
Азот поглощается тонким порошком Х. при 800–1000 °C с образованием нитрида CrN, а при 1200–1300 °C — Cr2N. Но обычно эти нитриды (табл.) получают действием NH3 на Х. (при ~ 850 °C). Нитриды, особенно CrN, обладают высокой хим. стойкостью. Их используют как компоненты твердых сплавов, катализаторы, а мононитрид — как полупроводниковый материал для термоэлектрич. генераторов. Х. сплавляется с бором, углеродом и кремнием с образованием соотв. боридов, карбидов и силицидов. Их применяют как компоненты твердых, жаростойких сплавов, износоустойчивых и химически стойких покрытий. С оксидами углерода Х. не взаимодействует.
СВОЙСТВА НЕКОТОРЫХ СОЕДИНЕНИЙ ХРОМА
таблица в процессе добавления
аИнконгруэнтао. бС разложением.
Пары S действуют на Х. при температурах выше 400 °C с образованием серии сульфидов от CrS до Cr5S8. Сульфиды образуются также при действии H2S (~ 1200 °C) и паров СS2. При сплавлении с Se X. дает селениды, по составу аналогичные сульфидам. Теллуриды имеют состав от CrТе до CrTe3. Металлы с сексвихалькогенидами Cr2Х3 дают халькогенохроматы(III). Большинство из них обладает полупроводниковыми свойствами и являются либо ферромагнетиками, либо антиферромагнетиками. Соед. с одновалентными металлами состава МCrХ2 большей частью имеют ромбоэдрич. решетку типа NaHF2. Для К, Rb и Cs известны также соед. типа MCr5S8. Двухвалентные металлы образуют соед. состава МCr2Х4, почти все они имеют структуру шпинели, часть их при высоких температурах и давлениях переходит в структуру типа NiAs. Для РЗЭ известны соед. типа МCrХ3.
Для Х. характерна способность к образованию многочисленных комплексных соед. в разных степенях окисления. Образование комплексов стабилизирует низшие степени окисления Х. Так, Cr(I) известен только в виде комплексов, напр. K3[Cr(CN)5NO]. Соед. Cr(II) неустойчивы, это сильные восстановители, легко окисляются на воздухе. Их водные растворы (небесно-голубого цвета, тогда как безводные соли бесцветные) сохраняются только в инертной атмосфере. Из растворов кристаллизуются гидраты, напр. Cr(ClO4)2 x 6H2O. Из комплексов Cr(II) самый распространенный синий K4[Cr(CN)6], дающий красно-оранжевые растворы.
Соед. Cr(III) наиб. устойчивы. В водных растворах катион Cr(III) существует в виде инертного аквакомплекса [Cr(H2O)6]3+ с очень малой скоростью обмена молекул воды на др. лиганды. Вследствие этого соли в растворах и в кристаллич. состоянии существуют в виде разноокрашенных изомеров — фиолетовых, содержащих указанный гексааквакатион, и зеленых, в которых анионы входят во внутр. сферу комплекса. Известно множество комплексов Cr(III) с координац. числом 6 и октаэдрич. конфигурацией, в большинстве химически инертных. К их числу относятся комплексы с нейтральными лигандами (из них наиб. изучены аммины) и с разнообразными анионами (галогенидные, цианидные, роданидные, сульфатные, оксалатные и др.). Характерны полиядерные формы комплексов с гидроксидными, кислородными, амминными, роданидными мостиками.
Нитрат Cr(NO3)3 x9H2O — пурпурные или темно-фиолетовые кристаллы; т. пл. 66 С, т. разл. 125 °C, 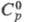 455 Дж/(моль∙К);
455 Дж/(моль∙К); 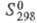 507 Дж/(моль∙К). Хорошо раств. в воде (44,8% по массе при 25 °C. в пересчете на безводную соль), этаноле и ацетоне, фиолетовый водный раствор при кипячении зеленеет. Описаны светло-голубой безводный нитрат, а также гидраты Cr(NO3)3 х nH2O: красновато-фиолетовый, п = 12,5; темно-коричневый и фиолетовый, п = 7,5; голубовато-зеленый, п = 3 и др. Получают нитрат взаимод. Cr(OH)3 с HNO3 или Ca(NO3)2 с Cr2(SO4)3 в водном растворе; применяют как протраву при крашении тканей, добавку при синтезе катализаторов.
507 Дж/(моль∙К). Хорошо раств. в воде (44,8% по массе при 25 °C. в пересчете на безводную соль), этаноле и ацетоне, фиолетовый водный раствор при кипячении зеленеет. Описаны светло-голубой безводный нитрат, а также гидраты Cr(NO3)3 х nH2O: красновато-фиолетовый, п = 12,5; темно-коричневый и фиолетовый, п = 7,5; голубовато-зеленый, п = 3 и др. Получают нитрат взаимод. Cr(OH)3 с HNO3 или Ca(NO3)2 с Cr2(SO4)3 в водном растворе; применяют как протраву при крашении тканей, добавку при синтезе катализаторов.
Соед. Cr(IV) немногочисленны — это простые и комплексные галогениды, а также хроматы(IV). Cr(V) реализуется в осн. в оксогалогенидах, напр., в CrOF3, в хроматах(V) и в галогенохроматах типа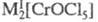 или M[CrOF4]. Cr(VI) образует многочисленные хроматы. В растворах он может присутствовать в виде ионов CrO3Х−, где X — галоген, CrO3(OSO3)2− и т. д. Соед. Cr(VI) — сильные окислители.
или M[CrOF4]. Cr(VI) образует многочисленные хроматы. В растворах он может присутствовать в виде ионов CrO3Х−, где X — галоген, CrO3(OSO3)2− и т. д. Соед. Cr(VI) — сильные окислители.
• см. также хрома карбонилы, хрома сульфаты, хроморганические соединения
Определение. X. относится к аналит. группе (NH4)2S. Для его обнаружения применяют реакции с H2O2 (синее окрашивание вследствие образования надхромовой кислоты), хромотроповой кислотой (красное окрашивание), бензидином (синее окрашивание).
Для определения Х. используют титриметрич. методы — титрование раствором соли Мора (NH4)2Fe(SO4)2 x6H2O после предварит. окисления Cr(III) персульфатом аммония, H2O2 и др. Для определения Cr(III) применяют комплексонометрич. метод (обратное титрование избытка комплексона разл. солями), потенциометрич. и амперометрич. титрование.
Для определения малых концентраций Х. используют фотометрич. методы, гл. обр. основанные на реакции с дифенилкарбазидом (красно-фиолетовое окрашивание). Методы, основанные на собств. окраске ионов Cr(III), хромат- и дихромат-ионов, а также синей окраске надхромовой кислоты, менее чувствительны.
Известны полярографич., люминесцентные, кинетич. методы определения Х. Перспективны газохроматографич. методы с использованием ацетилацетона и, особенно, его фторпроизводных — трифтор- и гексафторацетилацетона.
Применяют разнообразные физ. методы определения X., в первую очередь — спектральный анализ. Наиб. интенсивные линии спектра Х. отвечают длинам волн 425,435, 427,480 и 428,972 нм. Часто используют также линии УФ области, напр. 283,56 и 301,48 нм. При определении малых количеств Х. применяют методы предварит. отделения примесей и концентрирования путем отгонки, экстракции, осаждения и т. п.
Для определения Х. используются атомно-абсорбционная спектрометрия, рентгенофлюоресцентный анализ и, особенно, радиоактивационный анализ.
Получение. Хромитовые руды большей частью не обогащаются. Непосредств. металлургич. переработка хромитовых руд позволяет получать путем восстановит, плавки в электропечах только феррохром с содержанием 60–70% Cr (см. хрома сплавы), используемый в черной металлургии. Имеются способы получения из феррохрома соед. X., но гл. обр. их производство основано на окислит. обжиге хромита с Na2CO3 и доломитом при 1100–1200 °C. Образовавшийся Na2CrO4 выщелачивают водой и после очистки раствора от А1 действием H2SO4, CO2 или Na2Cr2O7 из раствора кристаллизуют либо Na2CrO4, либо Na2Cr2O7, либо раствор перерабатывают на др. соед. Х. Необходимый для получения металлич. X. Cr2O3 получают восстановлением щелочного раствора Na2CrO4 элементарной серой при кипячении или в автоклавах при 140–160 °C по реакции:
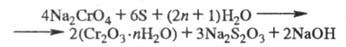
Затем раствор подкисляют H2SO4 и проводят вторую стадию восстановления с получением хромихромата или гидроксида Cr(II):
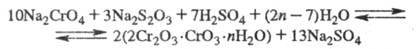
После сушки и прокаливания гидроксидных осадков получают Cr2O3.
Металлич. Х. большей частью производят восстановлением Cr2O3 алюминием или элементарным кремнием. Реже используют восстановление углеродом, при котором получают Х. с большим содержанием С. Предложены также процессы восстановления CrCl3 магнием. Более чистый Х. получают электролизом либо сернокислых растворов CrO3, либо растворов хромоаммониевых квасцов.
Для рафинирования Х. применяют обработку сухим или влажным H2 при высоких температурах, вакуумную дистилляцию, зонную плавку, иодидное рафинирование. Для получения особо чистого Х. предложено использовать термич. разложение орг. комплексов, напр. бис(этилбензол)хрома с послед. водородной очисткой металла.
Х. применяют в металлургии, в осн. как компонент сталей разл. назначения, в частности нержавеющих. Х. входит в состав жаропрочных сплавов на основе Ni и Со. Большие количества Х. используют для получения хромовых покрытий. Помимо высокой коррозионной стойкости они обладают большим сопротивлением истиранию. Разл. соед. Х. применяют в качестве огнеупорных материалов, пигментов, дубителей кожи, протрав при крашении, реактивов, магн. материалов и др. Соотношение областей использования: металлургия 75%, огнеупоры 10%, прочее 15%.
Мировая добыча хромитовых руд и концентратов (без России) ок. 12 млн. т в год; выплавка феррохрома 2,7 млн. т в год; производство металлич. Х. ок. 20 тыс. т в год (1990). Осн. производители — США, Япония, ЮАР, Германия, Франция, Италия, Великобритания.
Металлич. Х. малотоксичен, также малоадовиты соед. Х. низших степеней окисления [но в организме они могут перейти в соед. Cr(VI)]. Соед. Cr(VI) обладают местным и общетоксич. действием, вызывают поражение органов дыхания, кожи, слизистых оболочек, желудочно-кишечного тракта. Попадают в кровь, откладываются в печени, почках, эндокринных железах, зубах. ПДК (в пересчете на CrO3) 0,01 мг/м3, Cr6+ 0,0015 мг/м3 (атм. воздух). Х. открыт Л. Вокленом в 1797.
Лит.: Плинер Ю. Л., Игнатенко Г. Ф., Лаппо С. И., Металлургия хрома, М., 1965; Салли А., Брэидз Э., Хром, пер. с англ., 2 изд., М., 1971; Авербух Т. Д., Павлов П. Г., Технология соединений хрома, 2 изд., М., 1973; Лаврухина А. К., Юкина Л. В., Аналитическая химия хрома, М., 1979; Неорганические соединения хрома, Л., 1981.
П. И. Федоров
Значения в других словарях
- Хром — (лат. Cromium) Cr, химический элемент VI группы периодической системы Менделеева, атомный номер 24, атомная масса 51,996; металл голубовато-стального цвета. Природные стабильные изотопы: 50Cr (4,31%), 52Cr (87,76%), 53Cr (9,55%) и 54Cr (2,38%). Большая советская энциклопедия
- хром — -а, м. 1. Химический элемент, твердый металл серо-стального цвета (употребляется при изготовлении твердых сплавов и для покрытия металлических изделий). 2. Мягкая тонкая кожа, выдубленная солями этого металла. 3. Род желтой краски, получаемой из хроматов. [От греч. χρω̃μα — цвет, краска] Малый академический словарь
- хром — орф. хром, -а Орфографический словарь Лопатина
- хром — Хром/. Морфемно-орфографический словарь
- хром — ХРОМ а, м. chrome m. [krom] <�новолат. chromium <�лат. chroma <�гр. краска. 1. Химический элемент — твердый серебристый металл, употребляемый при изготовлении твердых сплаво и для покрытия металлических изделий. БАС-1. Словарь галлицизмов русского языка
- Хром — Мягкая тонкая кожа, выработанная хромовым дублением; используется для изготовления пальто, пиджаков, курток, головных уборов, верха обуви. Выделывается из шкур овец, свиней и телят (для одежды), шкур крупного рогатого скота и лошадей, свиней (для обуви). Энциклопедия моды и одежды
- хром — Заимств. в первой половине XIX в. из новолат. chromium < лат. chroma, передающего греч. chrōma «цвет, краска». Хром получил свое название по яркой окраске хромовых солей. Этимологический словарь Шанского
- ХРОМ — ХРОМ (символ Сr), серовато-белый ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, впервые выделенный в 1797 г. Главной рудой для его добычи является ХРОМИТ. Поверхность хрома тускло-серая, но он легко поддается полировке и широко используется для гальванических покрытий. Научно-технический словарь
- Хром — (Chromium; Cr) химический элемент периодической системы элементов Д.И. Менделеева; атомный номер 24, атомная масса 51,996; твердый металл серо-стального цвета; X. и его соединения токсичны для человека. Медицинская энциклопедия
- Хром — (Chromium), Cr (от греч. Chroma — цвет, краска; из-за разнообразия окраски соединений X. * a. chromium, chrome; н. Chrom; ф. chrome; и. cromo), — хим. элемент VI группы периодич. системы Mенделеева, ат. н. 24, ат. м. 51,9961. Природный X. Горная энциклопедия
- хром — 1. ХРОМ1, а, м. 1. Химический элемент, твёрдый светло-серый блестящий металл. 2. Род жёлтой краски (спец.). | прил. хромистый, ая, ое (к 1 знач.) и хромовый, ая, ое. Хромистая сталь. Хромовая руда. 2. ХРОМ2, а, м. Сорт мягкой тонкой кожи. | прил. хромовый, ая, ое. Хромовая обувь. Толковый словарь Ожегова
- хром — ХРОМ, хрома, мн. нет, ·муж. (·греч. chroma — цвет). 1. Химический элемент, твердый светлосерый металл, употр. при изготовлении твердых сплавов, красок, протрав, дубителей и т.п. (·хим. ). 2. Род желтой краски (спец.). II. ХРОМ, хрома, мн. нет, ·муж. Толковый словарь Ушакова
- хром — ХРОМ -а; м. [от греч. chrōma — цвет, краска] 1. Химический элемент (Сr), твёрдый металл серо-стального цвета (используется при изготовлении твёрдых сплавов и для покрытия металлических изделий). 2. Мягкая тонкая кожа, выдубленная солями этого металла. Толковый словарь Кузнецова
- хром — ХРОМ и хромий м. один из химических металлов, дающий в солях яркия краски, откуда и греческое названье. Хромиевый, хромовый к нему относящ. хромистый, хром или соли его в себе содержащий. Хромокислые соли. Толковый словарь Даля
- Хром — (Chrom, Chrome, Chromium; при О = 16 атомн. вес Cr = 52,1) принадлежит к числу элементарных веществ металлического характера. Однако, занимая по своему атомному весу шестое место в том большом периоде естественной системы элементов... Энциклопедический словарь Брокгауза и Ефрона
- хром — I. хрома, мн. нет, м. [греч. chroma – цвет]. 1. Химический элемент, твердый светло-серый металл, употр. при изготовлении твердых сплавов, красок, протрав, дубителей и т. п. (хим.). 2. Род желтой краски (спец.). II. хрома, мн. нет, м. [от греч. Большой словарь иностранных слов
- ХРОМ — ХРОМ (лат. Chromium) — Cr, химический элемент VI группы Периодической системы Менделеева, атомный номер 24, атомная масса 51,9961. Название от греч. chroma — цвет, краска (из-за яркой окраски соединения). Большой энциклопедический словарь
- хром — хром I м. 1. Химический элемент, твёрдый жаропрочный металл голубовато-стального цвета, не окисляющийся на воздухе, применяемый для покрытия поверхности других металлов (хромирования) с целью защиты их от коррозии. Толковый словарь Ефремовой
