хронопотенциометрия
ХРОНОПОТЕНЦИОМЕТРИЯ
электрохим. метод исследования и анализа, основанный на изучении изменения электродного потенциала Е во времени при контролируемом значении тока электролиза. Различают прямую и инверсионную Х. Чаще применяют первый вариант. В этом случае электролиз осуществляют в неперемешиваемом растворе определяемого электрохимически активного (электроактивного) вещества при большом избытке фонового электролита; при этом значение тока, как правило, превышает предельный диффузионный ток ld (см. вольтамперометрия). Используют двух- и трехэлектродные ячейки (см. хроноамперометрия). Регистрируют хроно-потенциометрич. кривую — зависимость электродного потенциала рабочего электрода (на котором происходит электролиз) от времени t.
У поверхности рабочего электрода постепенно уменьшается концентрация исследуемого вещества и соответственно изменяется электродный потенциал в сторону более отрицат. значений. В конце электролиза наблюдается резкий скачок потенциала. Интервал времени, в течение которого концентрация электроактивного вещества уменьшается практически до 0, наз. переходным временем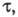 причем
причем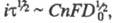 где С — объемная концентрация злектроактивного вещества; п — число электронов, участвующих в электрохим. процессе; F- число Фарадея; D0 — коэф. диффузии окисленной формы вещества; i — плотность электрич. тока. При постоянных значениях С и площади поверхности электрода произведение
где С — объемная концентрация злектроактивного вещества; п — число электронов, участвующих в электрохим. процессе; F- число Фарадея; D0 — коэф. диффузии окисленной формы вещества; i — плотность электрич. тока. При постоянных значениях С и площади поверхности электрода произведение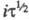 = const. Изменяя i, можно менять величину
= const. Изменяя i, можно менять величину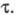 Необходимые условия проведения анализа — отсутствие конвекции и малое значение тока, расходуемого на заряжение двойного электрич. слоя. Обычно продолжительность электролиза t не превышает ~ 30 с, так как при больших t на величину
Необходимые условия проведения анализа — отсутствие конвекции и малое значение тока, расходуемого на заряжение двойного электрич. слоя. Обычно продолжительность электролиза t не превышает ~ 30 с, так как при больших t на величину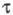 оказывают сильное влияние емкость двойного электрич. слоя, конвекция, адсорбция и др. факторы. Величина
оказывают сильное влияние емкость двойного электрич. слоя, конвекция, адсорбция и др. факторы. Величина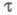 зависит также от формы электрода: для цилиндрич. электрода она меньше, чем для сферического с такими же радиусом и площадью поверхности. Если ток электролиза является функцией
зависит также от формы электрода: для цилиндрич. электрода она меньше, чем для сферического с такими же радиусом и площадью поверхности. Если ток электролиза является функцией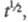 то
то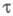 ~ С. Это соотношение лежит в основе количеств. хим. анализа. Значение
~ С. Это соотношение лежит в основе количеств. хим. анализа. Значение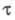 определяют по хронопотенциометрич. кривой, вид которой зависит от характера электрохим. процесса.
определяют по хронопотенциометрич. кривой, вид которой зависит от характера электрохим. процесса.
Для обратимого электрохим. процесса, скорость которого ограничивается диффузией электроактивного вещества (диффузионный процесс с переходным временем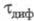 ), электродный потенциал
), электродный потенциал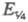 при
при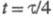 равен потенциалу полуволны Е1/2. Причем выражение для хронопотенциометрич. кривой в координатах E-t совпадает с уравнением для вольтамперометрич. волны, если вместо Е1/2, ldи I подставить соотв.
равен потенциалу полуволны Е1/2. Причем выражение для хронопотенциометрич. кривой в координатах E-t совпадает с уравнением для вольтамперометрич. волны, если вместо Е1/2, ldи I подставить соотв.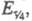
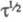 и
и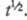
Для необратимого электрохим. процесса форма хронопотенциометрич. кривой определяется произведением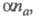 где
где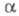 — коэф. переноса электрона; па — число электронов, участвующих в медленной стадии электрохим. реакции. Величина
— коэф. переноса электрона; па — число электронов, участвующих в медленной стадии электрохим. реакции. Величина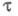 не зависит от кинетики электродной реакции. При t = 0 значение Е определяется константой скорости kf прямой гетерог. электрохим. реакции, величинами
не зависит от кинетики электродной реакции. При t = 0 значение Е определяется константой скорости kf прямой гетерог. электрохим. реакции, величинами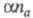 и i. Чем меньше kf , тем большее перенапряжение необходимо для протекания этого процесса. Величина смещения хронопотенциометрич. кривой в отрицат. область потенциалов возрастает с увеличением i. Это справедливо для процессов, протекающих на электродах сферич. и цилиндрич. формы. Условие необратимости электродного процесса в X.:
и i. Чем меньше kf , тем большее перенапряжение необходимо для протекания этого процесса. Величина смещения хронопотенциометрич. кривой в отрицат. область потенциалов возрастает с увеличением i. Это справедливо для процессов, протекающих на электродах сферич. и цилиндрич. формы. Условие необратимости электродного процесса в X.: 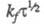 < 2,8∙10−2 см x с−1/2. Использование приема реверса (изменения знака) тока позволяет изучать процессы восстановления (катодные с
< 2,8∙10−2 см x с−1/2. Использование приема реверса (изменения знака) тока позволяет изучать процессы восстановления (катодные с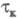 ) и окисления (анодные с
) и окисления (анодные с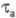 ), при этом
), при этом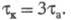
Если скорость электрохим. реакции лимигируется скоростью образования в растворе электроактивного вещества из определяемого компонента, то процесс наз. кинетическим (переходное время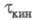 ); причем
); причем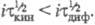 При i → 0 значение
При i → 0 значение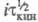 для кинетич. и диффузионных процессов сближаются. Увеличение i приводит к линейному уменьшению
для кинетич. и диффузионных процессов сближаются. Увеличение i приводит к линейному уменьшению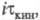 тем более резкому, чем меньше константа равновесия К и константа скорости k1 прямой хим. реакции образования электроактивного вещества. В случае каталитич. электродного процесса (см. полярография) с переходным временем
тем более резкому, чем меньше константа равновесия К и константа скорости k1 прямой хим. реакции образования электроактивного вещества. В случае каталитич. электродного процесса (см. полярография) с переходным временем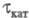 величина
величина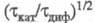 зависит от параметра
зависит от параметра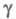 ; причем
; причем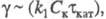 где Cк — концентрация катализатора. При
где Cк — концентрация катализатора. При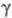 > 2 наблюдается линейная зависимость отношения
> 2 наблюдается линейная зависимость отношения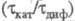 от
от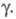
В инверсионной Х. предварительно проводят электролиз (электролитич. концентрирование) определяемого вещества в течение времени tK при заданном токе или потенциале. Выделенное на электроде вещество растворяют электрохимически при i = const или химически (чаще окислением, напр. с помощью Hg2+ или O2). Величина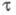 обычно пропорциональна концентрации электроактивного вещества и времени tK.
обычно пропорциональна концентрации электроактивного вещества и времени tK.
Х. применяют для определения ионов металлов в объектах окружающей среды (сточных и прир. водах, почвах, растениях, осадочных горных породах), а также в биосредах (кровь, моча). Пределы обнаружения достигают неск. мкг/л; относит. стандартное отклонение — неск. % (для малых концентраций менее 0,25%).
Лит.: Галюс З., Теоретические основы электрохимического анализа, пер. с польск., М., 1974; Агасян П. К. [и др.], "Ж. аналит. химии", 1976, т. 31, в. 1, с. 121–42; Захаров М. С., Баканов В. И., Пнев В. В., Хронопотенциометрия, М., 1978.
А. И. Каменев
