имиды карболовых кислот
ИМИДЫ КАРБОЛОВЫХ КИСЛОТ
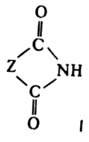
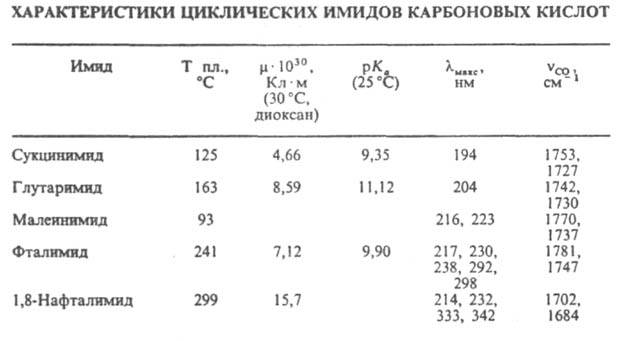
соед., содержащие группу —C(O)—NH—C(O)—. Линейные имиды — производные монокарбоновых кислот, напр. (CH3CO)2NH; их называют также диациламидами. Наиб. значение имеют циклич. имиды (формула I, где Z — орг. остаток) — производные дикарбоновых кислот, напр., сукцинимид. Имиды карбоновых кислот (И.) — кристаллич. вещества. Их физ. свойства представлены в таблице.
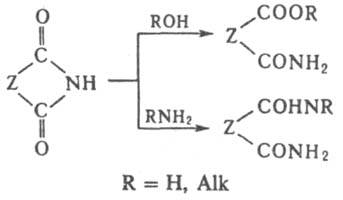
Они легко гидролизуются в кислой и щелочной средах до моноамидов дикарбоновых кислот (амидокислот). Алкоголиз приводит к амидоэфирам, аммонолиз и аминолиз — к диамидам:
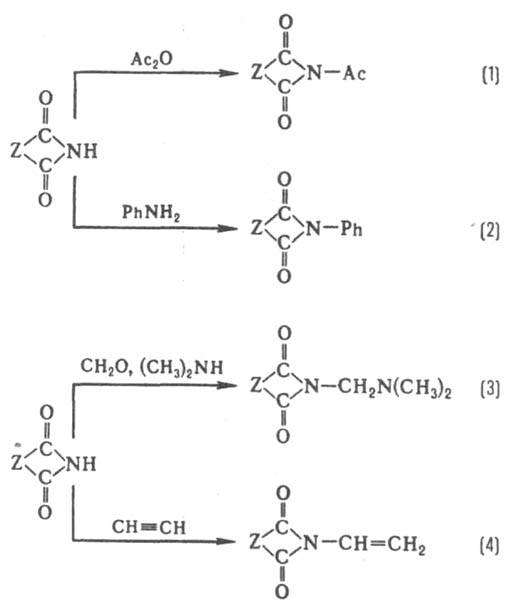
Большая по сравнению с амидами электрофильность карбонильных атомов углерода позволяет И. вступать не только в реакцию Гриньяра, но и в реакции Реформатского и Виттига, реагировать с ацетиленидом Na. В жестких условиях реакции протекают по обеим карбонильным группам. Присутствие двух карбонильных групп обусловливает повыш. кислотность И. по сравнению с амидами. И. ацилируются обычными ацилирующими агентами (реакция 1), обменивают иминную группу при действии ароматич. аминов (2), вступают в реакцию Манниха в качестве кислотного компонента (3), присоединяются по кратным связям (4):
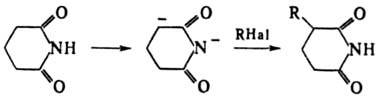
С основаниями И. образуют соли, гидролизующиеся в воде, но устойчивые в спирте. Алкилирование К-соли фталимида алкилгалогенидами и послед. гидролиз — классич. метод синтеза первичных аминов (см. Габриеля реакция). В реакции И. с галогенами или гипогалогенитами образуются N-галогенимиды (напр., N-бромсукцинимид), применяемые в орг. синтезе как источники атомарного или положительно заряженного галогена. В присутствии оснований N-галогенимиды претерпевают перегруппировку Гофмана. Обработка фталимида щелочным гипохлоритом лежит в основе пром. метода получения антраниловой кислоты. При взаимодействии циклич. И. с избытком NaNH2 образуется дианион, алкилирующийся по α-атому углерода, напр.:
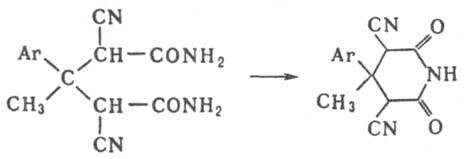
И. исключительно устойчивы к окислению, но легко восстанавливаются комплексными гидридами металлов, водородом в присутствии катализаторов или электрохимически, причем циклические образуют, в зависимости от условий, α-гидроксилактамы, лактамы или амины. Линейные И. получают ацилированием первичных или вторичных амидов ангидридами, галогенангидридами, изопропениловыми эфирами карбоновых кислот или кетенами. Циклич. И. образуются при циклизации азотсодержащих производных дикарбоновых кислот — моноамидов, диамидов, эфироамидов, мононитрилов, напр.:
И. также синтезируют каталитич. окислит. аминированием углеводородов (напр., фталимид — из ксилола), окислением азотсодержащих гетероциклов (напр., сукцинимид — из пиррола), карбонилированием амидов b,g-ненасыщенных кислот в присутствии Со(CO)8 (напр., глутаримид — из амида винилуксусной кислоты).
Анализ И. основан на их превращ. в гидроксамовые кислоты и колориметрич. определении последних, а также на полярографич. восстановлении. Производные И. — вулканизующие агенты, дисперсные красители и пигменты с высокой светопрочностью, регуляторы роста растений, фунгициды, бактерициды, лек. средства.
• см. также полиимиды
Лит.: Общая органическая химия, пер. с англ., т. 4, М., 1983, с. 388–536; Hargreaves М. К., Pritchard J. G., Dave H. R., "Chem. Rev.", 1970, v. 70, № 4, p. 439–69.
Д. В. Иоффе
