иминоэфиры
ИМИНОЭФИРЫ (имидаты)
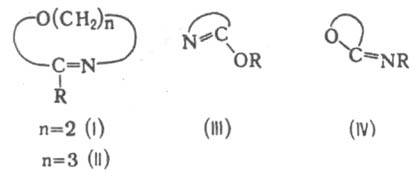
соед. общей формулы RC(=NR')OR:, где R и R' — H, Alk, Ar; R: — Alk, Ar; эфиры имидовых кислот (имидокислот) RC(=NR')OH — неустойчивых изомеров первичных или вторичных амидов карбоновых кислот. Известны также И., в которых фрагмент —О—C=N— входит в цикл полностью [напр., Δ2-оксазолины (формула I) и 5,6-дигидро-1,3-оксазины (II)] или частично [эфиры лактимов (III), иминолактоны (IV)].
При нагр. О-арилсодержащие И. перегруппировываются в N-ариламиды (перегруппировка Чепмена):
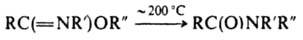
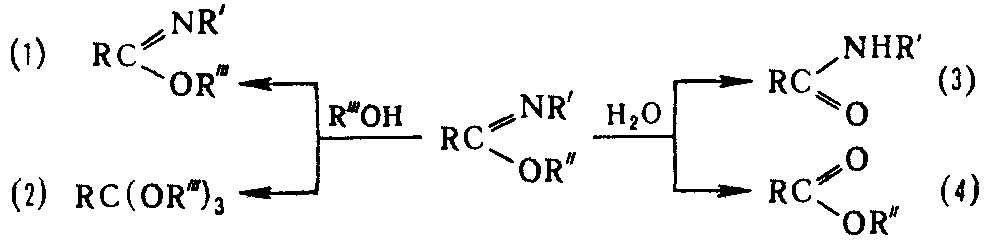
В случае R: = Alk такая перегруппировка катализируется алкилгалогенидами. Протонирование, алкилирование, ацилирование, галогенирование И. обычно осуществляется по атому Ν. Взаимод. со спиртами приводит к новым И. (уравнение 1) или к ортоэфирам (2), гидролиз в щелочной среде — к амидам (3), в кислой к сложным эфирам (4):
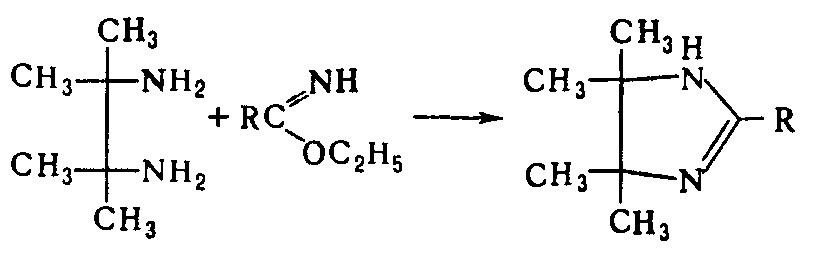
В реакции с H2S И. образуют эфиры тионкарбоновых кислот RC(S)OR", с аминами R'2"NH — амидины RC(=NR')NR2". C бифункциональными соед. дают гетероциклы, напр.:
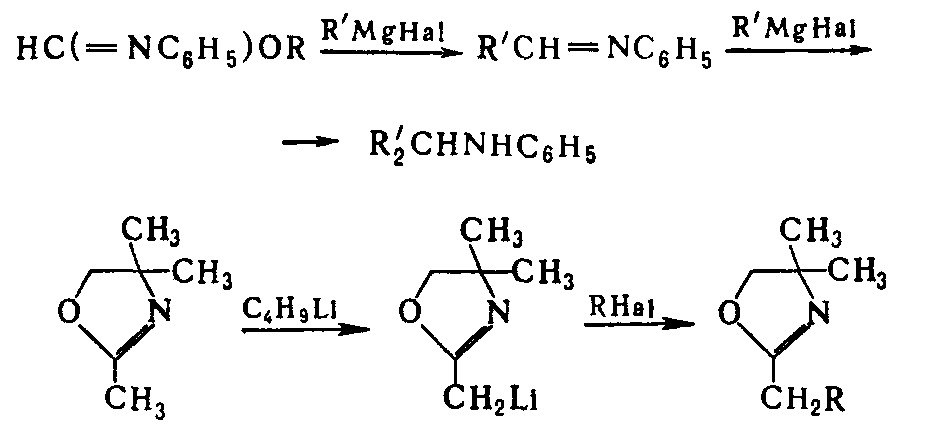
Металлоорг. соед. реагируют с И. по группе C=N или по α-атому H, напр.:
Связь C=N в И. способна участвовать в циклоприсоединении, напр., при взаимод. с кетенами образуются 4-алкокси-2-азетидиноны.
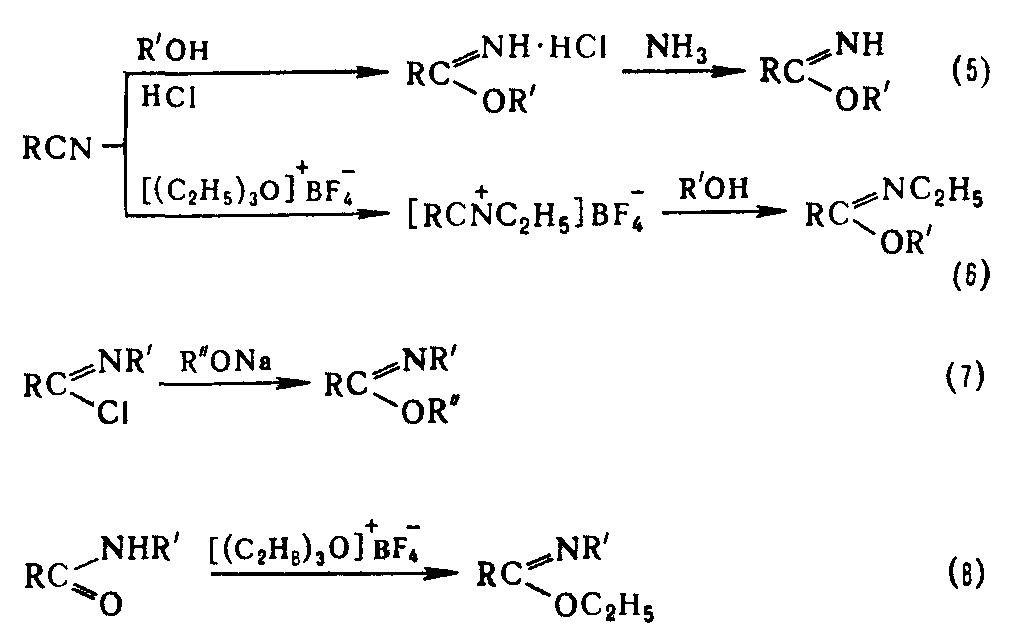
И. получают присоединением спиртов или фенолов к нитрилам (реакция Пиннера) (5), к нитрилиевым солям (6), кетениминам, изонитрилам, а также замещением галогена в имидоилгалогенидах (7), алкилированием амидов (8), аминолизом ортоэфиров, переэтерификацией др. иминоэфиров.
Используются И. в орг. синтезе.
Лит.: Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 598–607.
Е. М. Рохлин
