экстракция жидкостная
ЭКСТРАКЦИЯ ЖИДКОСТНАЯ (позднелат. extractio — извлечение, от extraho — вытягиваю, извлекаю)
перевод одного или неск. компонентов раствора из одной жидкой фазы в контактирующую и не смешивающуюся с ней др. жидкую фазу, содержащую избират. растворитель (экстрагент); один из массообменных процессов хим. технологии. Используется для извлечения, разделения и концентрирования растворенных веществ.
Экстрагенты обеспечивают переход целевых компонентов из исчерпываемой (тяжелой) фазы, которая чаще всего представляет собой водный раствор, в извлекающую (легкую) фазу (обычно орг. жидкость). Две контактирующие жидкие фазы и распределяемый между ними целевой компонент образуют экстракц. систему. Извлекающая фаза включает только экстрагент (или смесь экстрагентов) либо является раствором одного или неск. экстрагентов в разбавителе, служащем для улучшения физ. (вязкость, плотность) и экстракц. свойств экстрагентов. В качестве разбавителей используют, как правило, жидкости (керосин, бензол, хлороформ и др.) либо их смеси, которые в исчерпываемой фазе практически нерастворимы и инертны по отношению к извлекаемым компонентам раствора. Иногда к разбавителям добавляют модификаторы, повышающие растворимость экстрагируемых компонентов в извлекающей фазе или облегчающие расслаивание фаз (спирты, кетоны, трибутилфосфат и т. д.).
К осн. стадиям Э. ж. относятся: 1) приведение в контакт и диспергирование фаз; 2) разделение или расслаивание фаз на экстракт (извлекающая фаза) и рафинат (исчерпываемая фаза); 3) выделение целевых компонентов из экстракта и регенерация экстрагента, для чего наряду с дистилляцией наиб. часто применяют реэкстракцию (процесс, обратный Э. ж.), обрабатывая экстракт водными растворами веществ, обеспечивающих полный перевод целевых компонентов в раствор или осадок и их концентрирование; 4) промывка экстракта для уменьшения содержания и удаления механически захваченного исходного раствора.
В любом экстракц. процессе после достижения требуемых показателей извлечения фазы должны быть разделены. Эмульсии, образующиеся при перемешивании, обычно термодинамически неустойчивы, что обусловлено наличием избыточной своб. энергии вследствие большой межфазной поверхности. Последняя уменьшается из-за коалесценции (слияния) капель дисперсной фазы. Коалесценция энергетически выгодна (особенно в бинарных системах) и происходит до тех пор, пока не образуются два слоя жидкости (см. коалесценция, тонкие пленки).
Разделение эмульсий осуществляется, как правило, в две стадии. Сначала довольно быстро осаждаются (всплывают) и коалесцируют крупные капли. Значительно более мелкие капли остаются в виде "тумана", который отстаивается довольно долго. Скорость расслаивания зачастую определяет производительность аппаратуры всего экстракц. процесса. На практике для интенсификации разделения фаз используют центробежные силы и применяют разл. устройства или насадки, которые располагают в отстойниках (см. ниже). В ряде случаев расслаиванию способствует электрич. поле.
Осн. требования к пром. экстрагентам: высокая избирательность; высокая экстракц. емкость по целевому компоненту; низкая растворимость в рафинате; совместимость с разбавителями; легкость регенерации; высокие хим., а в ряде случаев и радиационная стойкость; негорючесть или достаточно высокая температура вспышки (более 60 °C); невысокая летучесть и низкая токсичность; доступность и невысокая стоимость.
Наиболее распространенные пром. экстрагенты подразделяют на след. классы: 1) нейтральные, извлечение которыми осуществляется по разным механизмам в зависимости от кислотности исходного раствора,- вода, фосфорорг. соед. (гл. обр. трибутилфосфат), нефтяные сульфоксиды, насыщенные спирты, простые и сложные эфиры, альдегиды, кетоны и др.; 2) кислые, которые извлекают катионы металлов в орг. фазу из водной,- фосфорорг. кислоты [ ди(2-этилгексил)фосфорная кислота], карбоновые и нафтеновые кислоты, сульфокислоты, алкилфенолы, хелатообразующие соед. (гидроксиоксимы, алкилгидроксихинолины, 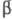 -дикетоны); 3) основные, с помощью которых извлекают анионы металлов из водных растворов,-первичные, вторичные, третичные амины и их соли, соли четвертичных аммониевых, фосфониевых и арсониевых оснований и др.
-дикетоны); 3) основные, с помощью которых извлекают анионы металлов из водных растворов,-первичные, вторичные, третичные амины и их соли, соли четвертичных аммониевых, фосфониевых и арсониевых оснований и др.
Равновесие при экстракции
Термодинамически Э. ж. — самопроизвольный процесс выравнивания хим. потенциалов веществ в контактирующих фазах (см. фазовое равновесие). Состояние равновесия характеризуется термодинамической константой распределения Рт, в общем случае описываемой выражением:
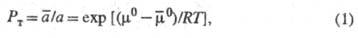
где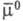 и
и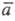 - соотв. стандартный хим. потенциал и термодинамич. активность распределяемого компонента в извлекающей фазе;
- соотв. стандартный хим. потенциал и термодинамич. активность распределяемого компонента в извлекающей фазе; 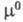 и а — то же для распределяемого компонента в исчерпываемой фазе; R — универсальная газовая постоянная; Т — температура.
и а — то же для распределяемого компонента в исчерпываемой фазе; R — универсальная газовая постоянная; Т — температура.
Разность хим. потенциалов переносимых компонентов в фазах представляет собой движущую силу Э. ж. Точное определение хим. потенциалов в экстракц. системах в настоящее время затруднительно. Поэтому для упрощения инженерных расчетов за движущую силу процесса принимают разность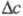 между фактическими (рабочими) и равновесными концентрациями целевого компонента в фазах.
между фактическими (рабочими) и равновесными концентрациями целевого компонента в фазах.
Для экстракц. равновесий справедливо фаз правило. Его применение к простейшей экстракц. системе (двухфазной из трех компонентов) при условии, что температура и давление обычно не изменяются, дает вариантность системы (т. е. число ее термодинамич. степеней свободы), равную единице. Это означает, что существует взаимно однозначное соответствие между равновесными концентрациями распределяемого компонента в исчерпываемой (с) и извлекающей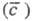 фазах. Благодаря этому для характеристики равновесного распределения используют кривую равновесия, или изотерму экстракции
фазах. Благодаря этому для характеристики равновесного распределения используют кривую равновесия, или изотерму экстракции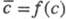 , и коэффициент распределения
, и коэффициент распределения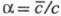 (рис. 1 и 2). При существенной взаимной растворимости фаз для описания экстракц. равновесий вместо декартовых координат применяют более сложные диаграммы, напр. в плоскости равностороннего треугольника (см. также диаграмма состояния).
(рис. 1 и 2). При существенной взаимной растворимости фаз для описания экстракц. равновесий вместо декартовых координат применяют более сложные диаграммы, напр. в плоскости равностороннего треугольника (см. также диаграмма состояния).
По величине коэф.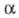 судят об экстракц. способности экстрагента: чем больше этот параметр, тем выше способность данного растворителя извлекать целевой компонент. В экстракц. системах коэф. α изменяется в широких пределах. Знание закономерностей экстракц. равновесий и уравнений для их описания позволяет выбирать условия, обеспечивающие необходимые значения а.
судят об экстракц. способности экстрагента: чем больше этот параметр, тем выше способность данного растворителя извлекать целевой компонент. В экстракц. системах коэф. α изменяется в широких пределах. Знание закономерностей экстракц. равновесий и уравнений для их описания позволяет выбирать условия, обеспечивающие необходимые значения а.
Для характеристики экстракц. разделения двух веществ используют коэффициент разделения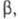 численно равный отношению соответствующих коэф. распределения этих веществ (обычно большего к меньшему) в экстракте и рафинате:
численно равный отношению соответствующих коэф. распределения этих веществ (обычно большего к меньшему) в экстракте и рафинате: 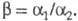 Факторы, влияющие на экстракц. разделение, многочисленны и определяются не только закономерностями экстракц. равновесия, но и способом организации процесса (см. ниже). Например, при однократном контакте фаз наилучшее разделение двух компонентов в состоянии равновесия достигается при макс. различии их степеней извлечения. Для практич. реализации разделения при многоступенчатой противоточной Э. ж. бывает достаточно
Факторы, влияющие на экстракц. разделение, многочисленны и определяются не только закономерностями экстракц. равновесия, но и способом организации процесса (см. ниже). Например, при однократном контакте фаз наилучшее разделение двух компонентов в состоянии равновесия достигается при макс. различии их степеней извлечения. Для практич. реализации разделения при многоступенчатой противоточной Э. ж. бывает достаточно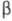 = 1,5–2,0 (разделение лантаноидов и др.).
= 1,5–2,0 (разделение лантаноидов и др.).
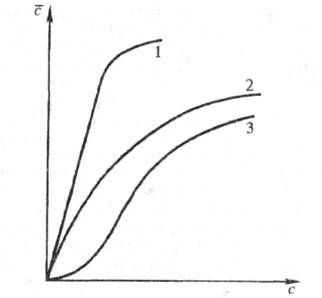
Рис. 1. Типичные изотермы экстракции неэлектролитов (1,2) и электролитов (2,3).
Рис. 2. Типичные зависимости α=/(с) при экстракции неэлектролитов (1,2) и электролитов (2,3).
На экстракц. равновесие сильное влияние оказывают также коэф. активности компонентов в фазах, что объясняется относительно небольшим изменением своё , энергии при экстракции (до 11 кДж/моль).
Уравнение (1) — самое общее выражение, характеризующее экстракц. равновесие. Вид этого уравнения применительно к конкретной экстракц. системе обусловлен природой и состоянием веществ в фазах. По данным признакам различают распределение в след, экстракц. системах: неэлектролит — неэлектролит, электролит — неэлектролит, электролит — электролит.
Экстракция в системах неэлектролит — неэлектролит. Для этих систем, в которых экстракция не сопровождается хим. реакциями, характерно т. наз. физическое распределение, обусловленное сравнительно слабыми ван-дер-ваальсовыми взаимод. экстрагента с извлекаемым веществом. В этом случае:

где и
и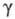 - коэф. активности экстрагируемого вещества соотв. в извлекающей и исчерпываемой фазах. При
- коэф. активности экстрагируемого вещества соотв. в извлекающей и исчерпываемой фазах. При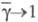 и
и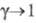 коэф.
коэф.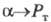 (закон Бертло — Нернста). Выражению (2) отвечают начальные участки равновесных кривых 1 на рис. 1 и 2. Отклонения от линейности в области больших концентраций вызваны изменениями коэф. активности веществ в фазах.
(закон Бертло — Нернста). Выражению (2) отвечают начальные участки равновесных кривых 1 на рис. 1 и 2. Отклонения от линейности в области больших концентраций вызваны изменениями коэф. активности веществ в фазах.
Экстракция в системах электролит — неэлектролит, в которых электролит диссоциирует в водной фазе, возможна лишь при условии образования сравнительно прочной хим. связи (энергия связи 40–200 кДж/моль) между экстрагентом и извлекаемым компонентом. Количеств. описание экстракц. равновесий в данных системах основано на применении действующих масс закона. Хим. связь между извлекаемым компонентом и экстрагентом м. б. образована в результате реакций присоединения (по сольватному или гидратно-сольватному механизму), катионного или анионного обмена, а также разл. сочетаний этих процессов.
Сольватный и гидратно-сольватный механизмы типичны для нейтральных экстрагентов. Реализация каждого механизма зависит от соотношения между своб. энергиями гидратации извлекаемого компонента и его взаимод. с экстрагентом. Для экстрагентов этого класса характерно существ. влияние на экстракц. равновесие гидратации, сольватации и (в случае достаточно разбавл. растворов) электролитич. диссоциации в орг. фазе.
По сольватному механизму с образованием донорно-акцепторных связей извлекаются соли металлов (напр., экстракция нитратов урана, тория, лантаноидов трибутилфосфатом), с образованием водородной связи — некоторые кислоты (напр., экстракция HNO3 триоктилфосфиноксидом). Процессы экстракции м. б. записаны, напр., так:
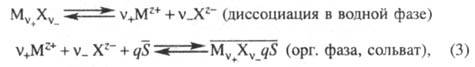
где М — извлекаемый металл; X — анион; 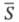 - экстрагент; v+, v-, q — стехиометрич. коэф.; z — зарядовое число; черта над знаком или формулой означает нахождение вещества в извлекающей (в данном случае, органической) фазе.
- экстрагент; v+, v-, q — стехиометрич. коэф.; z — зарядовое число; черта над знаком или формулой означает нахождение вещества в извлекающей (в данном случае, органической) фазе.
Константа равновесия суммарной хим. реакции образования извлекаемого соед. наз. термодинамической константой экстракции (КТ). Например, для реакции (3) имеем:
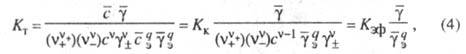
где Кки Кэф — концентрационная и эффективная константы экстракции (для практич. целей часто ограничиваются расчетом только Kк) 
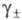 - средний ионный коэф. активности ионов; сэ и
- средний ионный коэф. активности ионов; сэ и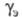 - исходная концентрация и коэф. активности экстрагента. Для извлечения по сольватному механизму характерно вытеснение воды из орг. фазы при возрастании в ней содержания извлекаемого компонента.
- исходная концентрация и коэф. активности экстрагента. Для извлечения по сольватному механизму характерно вытеснение воды из орг. фазы при возрастании в ней содержания извлекаемого компонента.
Гидратно-сольватный механизм реализуется за счет взаимод. экстрагента с гидратной оболочкой экстрагируемых компонентов. Поэтому по мере извлечения в орг. фазе увеличивается содержание воды, равновесная концентрация которой зависит от разл. факторов. Такой механизм характерен для экстракции сильных кислот (напр., HCl, HClO4) трибутилфосфатом, а также солей металлов спиртами, простыми и сложными эфирами, кетонами и др. слабоосновными экстрагентами.
Для реакций, протекающих по механизму присоединения, характерно стремление α к нулю при уменьшении концентрации извлекаемого компонента в исчерпываемой фазе вследствие увеличения его степени диссоциации. Поэтому в системах с нейтральными экстрагентами зачастую используют высаливатели (см. высаливание) — обычно неэкстрагирующиеся электролиты с одноименным по отношению к извлекаемому компоненту анионом. Введение высаливателя приводит к изменению формы изотермы экстракции и увеличению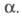
Катионный обмен типичен для экстракции ионов металлов кислыми экстрагентами, напр. фосфорорг., карбоновыми и др. кислотами. Образующаяся соль, как правило, сольватирована молекулами экстрагента:
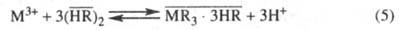
Для таких процессов наблюдается линейное возрастание lg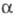 с увеличением pH, что является следствием закона действующих масс. В ряде случаев (напр., при экстракции U фосфорорг. кислотами) наряду с ионным обменом возможно образование координац. связи между фосфорильной группой и извлекаемым компонентом.
с увеличением pH, что является следствием закона действующих масс. В ряде случаев (напр., при экстракции U фосфорорг. кислотами) наряду с ионным обменом возможно образование координац. связи между фосфорильной группой и извлекаемым компонентом.
Анионный обмен характерен для экстракции минеральных кислот и ионов металлов солями аминов и четвертичных аммониевых оснований, напр.:
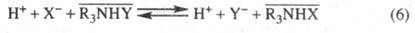
Экстракция соед. металлов солями аминов возможна также и по механизму реакций присоединения. Для экстракции с помощью этих веществ типично сильное влияние на параметры равновесия процессов ассоциации в орг. фазе.
Извлечение ионов металлов кислыми хелатообразующими экстрагентами, а также смесями, напр. нейтральных и кислых экстрагентов, происходит по смешанному механизму. В первом случае катионный обмен дополняется донорно-акцепторными взаимод. с участием донорных атомов (обычно N или О) экстрагента. Во втором случае более полно реализуются координац. возможности иона металла за счет образования смешанных комплексов типа M[XZSq]. Повышенная прочность комплексов обусловливает увеличение коэф.
Экстракция в системах электролит-электролит ограниченно распространена в промышленности и используется гл. обр. в науч. исследованиях. Описание равновесий в этих системах в отличие от рассмотренных требует учета электролитич. диссоциации компонентов растворов в обеих фазах.
Синергизм. При экстракции смесями экстрагентов часто наблюдаются изменения коэф. α вследствие изменений коэф. активности извлекаемого компонента в фазах или образования сольватов. Такой эффект, наз. синергетическим или синергизмом, выражается в том, что экспериментально определяемый коэф. α оказывается больше этого коэф., вычисленного по схеме аддитивности. Синергизм обычно реализуется при невысоких концентрациях распределяемого компонента в извлекающей фазе. При более полном использовании емкости экстрагента наблюдается противоположный эффект (антагонизм), при котором коэф.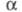 меньше суммы коэф. распределения компонентов данной системы.
меньше суммы коэф. распределения компонентов данной системы.
Кинетика экстракции Э. ж., как и любой реальный процесс, протекает во времени. Кинетически Э. ж. представляет собой массопередачу (см. массообмен), которая сопровождается разнообразными физ.-хим. процессами, происходящими на межфазной границе, в прилегающих к ней слоях и в объемах фаз. Скорость экстракции, или количество вещества, переходящего в единицу времени из одной фазы в другую, определяется по формуле:
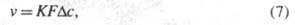
где К — коэф. массопередачи; F — площадь межфазной поверхности; 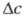 — движущая сила процесса. Если параметры v, F и
— движущая сила процесса. Если параметры v, F и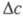 известны, то можно найти значение плотности межфазного потока (j), коэф. массопередачи и обратную ему величину — т. наз. сопротивление массопередаче (Rм):
известны, то можно найти значение плотности межфазного потока (j), коэф. массопередачи и обратную ему величину — т. наз. сопротивление массопередаче (Rм):
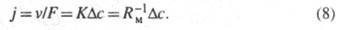
В зависимости от природы Rм или, иными словами, в зависимости от того, каким конкретно процессом (хим. реакцией или диффузией) лимитируется скорость извлечения вещества, м. б. предложены разл. способы воздействия на скорость экстракции. Возможны два осн. пути ее регулирования:
1) введением в экстракц. систему мех. энергии, затрачиваемой на принудит. перемешивание и диспергирование фаз с целью увеличения поверхности их контакта и коэф. массоотдачи в фазах;
2) воздействием на скорость хим. реакций и межфазных физ.-хим. процессов.
В хим. технологии в качестве гл. фактора интенсификации Э. ж. используют первый путь, т. к. обычно скорость экстракции лимитируется диффузией. Однако необходимо учитывать, что возрастание межфазной поверхности и коэф. массоотдачи в фазах становится все менее заметным по мере увеличения интенсивности принудит. перемешивания. Поэтому попытки дальнейшего ускорения экстракции за счет дополнит. затрат
мех. энергии могут оказаться неэффективными. Кроме того, при интенсивных режимах перемешивания возможно снижение скорости разделения фаз на последующих стадиях процесса. Если скорость извлечения вещества ограничена скоростью медленных хим. реакций в фазах, то при прочих равных условиях скорость экстракции не зависит от размера межфазной поверхности. Интенсификация экстракц. процесса возможна лишь за счет ускорения самих реакций.
В подавляющем большинстве экстракц. систем, особенно при интенсивном перемешивании, сопротивление массопердаче Rм сосредоточено в межфазной области. Это означает, что все действующие в ней факторы будут оказывать влияние на коэф. массопередачи. К числу таких факторов относятся: межфазные реакции между экстрагентом и извлекаемым веществом; блокировка межфазной поверхности в результате аккумуляции на ней труднорастворимых продуктов реакций, микрокапель, твердых частиц или, др. словами, вследствие образования в межфазной области конденсир. меж фазных пленок и зон микрогетерогенности; влияние процессов адсорбции — десорбции и двойного электрич. слоя; самопроизвольная межфазная конвекция из-за нарушения гидродинамич. стабильности границы раздела фаз (эффект Марангони).
Знание закономерностей кинетики процесса и информация о коэф. массопередачи необходимы для расчетов экстракц. аппаратуры и определения путей интенсификации Э. ж.
Способы организации процесса Э. ж. осуществляют в аппаратах, наз. экстракторами, с однократным и многократным контактом фаз. Соотв. различают однократную (одноступенчатую) и многократную (многоступенчатую) экстракцию; при этом ступенями разделения служат отдельные аппараты или их секции.
Многократная экстракция, наиб. распространенная в промышленности, проводится непрерывно и по способу движения фаз подразделяется на противоточную, полупротивоточную и перекрестноточную. Чаще всего применяют противоточную экстракцию одним экстрагентом (рис. 3) с числом ступеней обычно 5–10. Для трудноразделяемых компонентов (напр., близких по свойствам лантаноидов) число ступеней достигает 70–100.
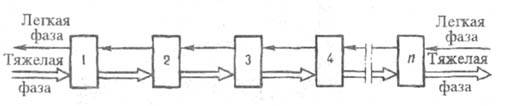
Рис. 3. Схема ггротивоточной многократной экстракции: 1 — 4, ..., n — экстракторы.
Четкость разделения исходной смеси можно повысить, используя след. способы. При Э. ж. с обратной флегмой экстрагент и рафинат частично отделяются от соотв. экстракта и исходного раствора; далее определенные доли этих фракций обратно возвращаются в экстрактор навстречу уходящим потокам (процесс проводят подобно ректификации). При Э. ж. с двумя несмешивающимися экстрагентами каждый из них избирательно растворяет к.-л. компонент или группу компонентов экстракц. системы.
Реже используют полупротивоток и перекрестный ток. При полупротивоточной экстракции одна фаза "неподвижна" (не перемещается со ступени на ступень), а др. фаза последовательно проходит все ступени каскада (см. ниже), вымывая компоненты раствора в порядке убывания коэф.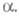 Полупротивоток применяют для извлечения и разделения компонентов, присутствующих в системе в очень малых количествах. При необходимости более полного извлечения целевого компонента из исходного раствора иногда используют перекрестноточную экстракцию (рис. 4): исчерпываемая фаза движется последовательно вдоль ступеней каскада, а извлекающая фаза поступает на каждую ступень и с нее же выводится.
Полупротивоток применяют для извлечения и разделения компонентов, присутствующих в системе в очень малых количествах. При необходимости более полного извлечения целевого компонента из исходного раствора иногда используют перекрестноточную экстракцию (рис. 4): исчерпываемая фаза движется последовательно вдоль ступеней каскада, а извлекающая фаза поступает на каждую ступень и с нее же выводится.
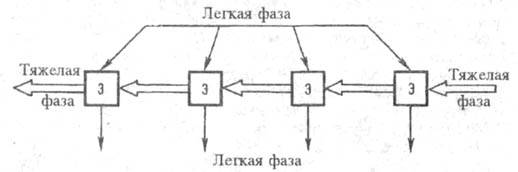
Рис. 4. Схема перекрестноточной многократной экстракции (Э — экстракторы).
Однократная экстракция, осуществляемая периодически или непрерывно, возможна лишь при высоких значениях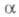 и применяется преим. для аналит. целей. Примером пром. реализации одноступенчатого процесса может служить мембранная экстракция, основанная на использовании мембран жидких и сочетающая одновременно прямой процесс и реэкстракцию. Роль мембран выполняет слой орг. жидкой фазы, разделяющий два водных раствора — исчерпываемый и извлекающий. Жидкая мембрана обычно содержит активный компонент — экстрагент, служащий для переноса целевых компонентов из исчерпываемой фазы в извлекающую. Разновидность мембранной Э. ж. — экстракция во множественных эмульсиях вода — масло — вода.
и применяется преим. для аналит. целей. Примером пром. реализации одноступенчатого процесса может служить мембранная экстракция, основанная на использовании мембран жидких и сочетающая одновременно прямой процесс и реэкстракцию. Роль мембран выполняет слой орг. жидкой фазы, разделяющий два водных раствора — исчерпываемый и извлекающий. Жидкая мембрана обычно содержит активный компонент — экстрагент, служащий для переноса целевых компонентов из исчерпываемой фазы в извлекающую. Разновидность мембранной Э. ж. — экстракция во множественных эмульсиях вода — масло — вода.
Оптимизация экстракции. Э. ж. — многофакторный процесс, мат. описание и оптимизация которого требуют сведения воедино совокупности равновесных, кинетич., гидродинамич., конструктивных данных и результатов масштабирования (см. масштабный переход). Эта задача успешно решается с помощью структурного моделирования экстракц. процессов. В основе его лежат т. наз. структурные модели, адекватно описывающие равновесие, кинетику и аппаратурное оформление каждого реального процесса. В отличие от функциональных моделей, которые также используются для описания экстракц. процесса, но рассматривают его или отдельные элементы лишь с целью установления количеств. корреляции между отдельными параметрами, структурные модели обладают более широкими экстраполяц. возможностями и пригодны для оптимизации Э. ж. на стадии пром. проектирования.
Аппаратурное оформление процесса. По способу контакта фаз пром. экстракторы подразделяют на дифференциально-контактные (колонные аппараты), ступенчатые и промежуточные конструкции. Аппараты первой группы отличаются непрерывным контактом фаз и плавным изменением концентрации извлекаемого компонента вдоль длины (высоты) аппарата. При таком профиле концентраций фазы ни в одной точке экстрактора не приходят в равновесие. Эти аппараты более компактны и требуют ограниченных производств. площадей, однако в них за счет продольного перемешивания (обусловлено конвективными осевыми потоками, застойными зонами, турбулентными пульсациями и т. д.) может значительно уменьшаться средняя движущая сила.
Аппараты второй группы состоят из дискретных ступеней, в каждой из которых осуществляется контакт фаз, после чего они разделяются и движутся противотоком в послед. ступени. Продольное перемешивание выражено слабее, но необходимость разделения фаз между соседними ступенями может приводить (при плохо отстаивающихся системах) к существ. увеличению размеров экстрактора.
Колонные экстракторы подразделяют на гравитационные и с внеш. подводом энергии. Эффективность колонн оценивают кпд отдельных ступеней разделения, высотой, эквивалентной теоретич. ступени (ВЭТС), либо высотой единицы переноса (ВEП). ВЭТС зависит от гидродинамич. режима в колонне и физ.-хим. свойств экстракц. системы. Высоту (длину) колонны, в которой проводится многоступенчатый процесс, рассчитывают по формуле: H = N x ВЭТС(ВЕП), где N — необходимое число ступеней, определяемое, как правило, графически по изотермам экстракции и материальным балансам или с помощью расчетов на ЭВМ.
Гравитационные экстракторы. В них движение взаимодействующих жидкостей происходит под действием разности плотностей фаз; поверхность их контакта образуется за счет собств. энергии потоков. К этим аппаратам относятся распылительные, насадочные и ситчатые экстракторы.
Распылит. экстракторы (рис. 5) — полые колонны, снабженные соплами, инжекторами и др. распылителями для диспергирования взаимодействующих фаз. Такие аппараты отличаются простотой и высокой производительностью, но сравнительно невысокой эффективностью. Несколько более эффективны, но менее производительны насадочные экстракторы, не отличающиеся по устройству от др. подобных массообменных аппаратов (см. также насадочные аппараты). Ситчатые экстракторы представляют собой колонны с перфорир. тарелками, снабженными переливными устройствами (см. также тарельчатые аппараты). Одна из взаимодействующих жидкостей, проходя через отверстия тарелок, диспергируется; благодаря этому создается большая поверхность контакта с встречной жидкостью, протекающей по переливным устройствам в виде сплошной фазы. Ситчатые экстракторы уступают по производительности только распылит. экстракторам, надежны в работе (вследствие простоты конструкции и отсутствия движущихся частей), однако имеют низкую эффективность.
По сравнению с др. колонными аппаратами все гравитац. экстракторы малоэффективны (ВЭТС может достигать 3 м) из-за относительно небольшой площади уд. поверхности контакта фаз, обусловленной крупными размерами капель (до неск. мм). Подвод энергии позволяет раздробить капли (до десятых долей мм), в результате чего требуемую высоту колонны можно уменьшить на порядок.
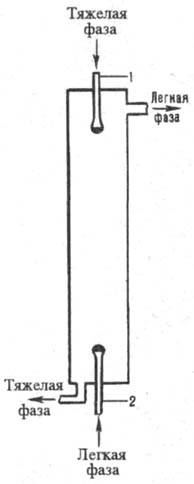
Рис. 5. Распылительный экстрактор: 1,2 — распылители.
Экстракторы с внешним подводом энергии подразделяются на пульсационные (см. пульсационные аппараты), вибрационные (см. вибрационная техника), с мех. перемешиванием. К аппаратам последнего типа относятся экстракторы роторно-дисковые и с чередующимися смесит. и отстойными насадочными секциями (колонны Шайбеля). В роторно-дисковых аппаратах (рис. 6) вращающиеся диски перемешивают и диспергируют контактирующие жидкости, после чего они расслаиваются. В колоннах Шайбеля (рис. 7) лопастные или турбинные мешалки размещены на общем вертикальном валу попеременно со слоями неподвижной насадки. Перемешанные жидкости, пройдя через слой насадки, расслаиваются.
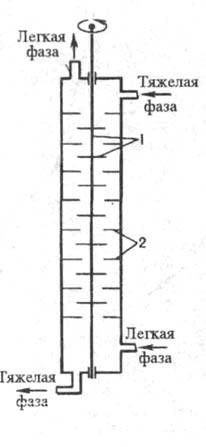
Рис. 6. Роторно дисковый экстрактор: 1 — ротор (вал с дисками); 2 — кольцевые перегородки статора.
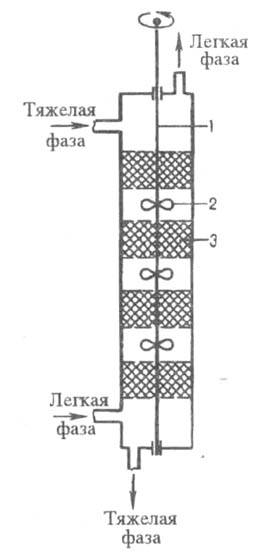
Рис. 7. Экстрактор с чередующимися смесительными и отстойными секциями (колонна Шайбеля): 1 — вал; 2 — мешалка; 3 — насадка.
Ступенчатые экстракторы. К ним относятся разл. типы смесителей-отстойников. Секция такого аппарата по эффективности приближается к одной теоретич. ступени. Требуемого числа ступеней достигают соединением секций в каскад. Зачастую неск. секций, разделенных перегородками, объединяют в одном корпусе (ящичные экстракторы; рис. 8). Каждая секция (ступень) имеет смесит. и отстойную камеры. Перемешивание фаз м. б. пульсационным или механическим (чаще всего применяют турбинные мешалки, одновременно транспортирующие жидкости из ступени в ступень).
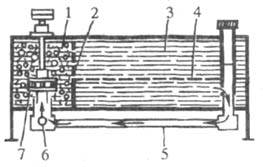
Рис. 8. Ящичный экстрактор: 1,3 — смесительная и отстойная камеры; 2 — перегородка; 4 — граница раздела фаз; 5 — рециркуляц. труба; 6 — всасывающий коллектор; 7 — турбинная мешалка.
Достоинства смесителей-отстойников: возможность варьирования нагрузок в широких пределах; возможность быстрого достижения требуемой производительности после остановки процесса; возможность формирования каскадов из большого числа ступеней; простота эксплуатации. Недостатки: большие объемы перерабатываемых в аппаратах растворов и опасность возникновения пожаров; медленное установление равновесия; большое число мех. и пневматич. устройств; повышенная чувствительность к твердым загрязнениям, что снижает надежность работы; высокая металлоемкость. Смесители-отстойники имеют преимущества перед колонными экстракторами в процессах с малым или очень большим числом ступеней, а также в процессах с большими потоками (до 1000 м3/ч).
Экстракторы промежуточных конструкций. Среди аппаратов, занимающих промежуточное положение между дифференциально-контактными и ступенчатыми, наиб. распространены центробежные экстракторы, в которых разделение, а иногда и перемешивание фаз происходят в поле действия центробежных сил. Рабочий орган (ротор) этих аппаратов состоит из набора перфорир. с обоих концов цилиндров, спиральных лент и др. Исходный раствор и экстрагент движутся навстречу один другому, причем более тяжелая фаза — от центра к периферии, а более легкая — в обратном направлении. Контакт жидкостей происходит на пути их движения, а диспергирование — при прохождении через перфорир. части цилиндров.
Центробежные экстракторы подразделяют на камерные (дискретно-ступенчатые) и дифференциально-контактные. Аппараты первой группы состоят из отдельных ступеней (камер), в каждой из которых движущиеся противотоком фазы последовательно перемешиваются и разделяются (напр., экстракторы "Лувеста" и "Робатель"). В аппаратах второй группы процесс протекает при близком к непрерывному контакту движущихся встречных потоков фаз; движение происходит по каналам, образованным внутр. перегородками ротора (напр., экстракторы Подбильняка).
Центробежные экстракторы отличаются высокими производительностью (потоки до сотен м3/ч) и эффективностью (3–10 теоретич. ступеней), малой продолжительностью контакта фаз (неск. секунд и менее), интенсивным массообменом. Такие аппараты перспективны в производствах неустойчивых соед. (напр., антибиотики), при переработке высокорадиоактивных растворов и стойких эмульсий, систем с близкими плотностями фаз.
Выбор экстракторов оптим. конструкций для конкретных пром. процессов должен базироваться на технико-экономич. сравнении аппаратов с учетом эффективности их работы, производительности, разделит, способности, энергетич., капитальных и эксплуатац. затрат.
В лаб. практике применяют в осн. те же, что и в промышленности, способы Э. ж., проводимой в стеклянных, металлич. или полимерных экстракторах разнообразных конструкций, простейшие из которых — делительные воронки, прибор Льюиса (хим. стакан с мешалками) и др.
Области применения экстракционных процессов
Экстракция органических соединений широко распространена в основном орг. синтезе, нефте-, коксо- и лесохимии и др. отраслях промышленности. Примеры: разделение смесей углеводородов нефтяных фракций на группы компонентов близкого хим. состава (ароматич. углеводороды и легкие парафины); извлечение ароматических углеводородов (бензол, толуол, ксилолы) из продуктов каталитич. риформинга; очистка смазочных масел; выделение фенолов из фракций кам.-уг. смолы; извлечение бутадиена из смеси углеводородов в производстве СК; извлечение из водных растворов орг. кислот с послед, их концентрированием (уксусная, акриловая, лимонная кислоты). В хим.-фармацевтич. и микробиол. отраслях промышленности экстракцию используют в производстве лек. препаратов — алкалоидов, антибиотиков, витаминов, гормонов; в пищ. промышленности — для очистки масел и жиров и др.
Экстракция неорганических соединений. Применение Э. ж. в гидрометаллургии позволяет создавать эффективные технол. схемы, обеспечивающие комплексную переработку минер. сырья и вторичных ресурсов. Экстракцию используют в технологии U и облученного ядерного горючего (извлечение и разделение U и Pu, выделение радионуклидов), редких и рассеянных (Be, Zr, Hf, Nb, Ta, РЗЭ, Mo, W, Re и др.), цветных (А1, Cu, Ni, Co, Zn и др.) и благородных (Ag, Au, Pt и др.) металлов, а также высокочистых соед. Fe (см. также, напр., Выщелачивание, Гидрометаллургия).
Важная область применения экстракции — очистка H3PO4. Процесс можно проводить, экстрагируя кислоту из водной фазы, загрязненной примесями, в орг. растворитель или извлекая неже-лат. примеси в экстрагент.
Охрана окружающей среды. С этой целью экстракцию используют для очистки технол. растворов и сточных вод и выделения из них ценных (напр., фенолы, метиленхлорид, некоторые хладоны) и токсичных веществ (см. также охрана природы).
Экстракция в аналит. химии и радиохимии. В аналит. химии Э. ж. применяют с целью селективного извлечения целевых хим. элементов из смесей для количеств, анализа, а также для определения содержания примесей в исследуемых соед., что важно при получении особо чистых веществ. Как метод аналит. химии Э. ж. отличают высокая избирательность, простота проведения, универсальность (возможность выделения практически любого элемента).
В радиохимии Э. ж. используют гл. обр. для очистки радиоактивных веществ от примесей, извлечения из облученных мишеней радионуклидов и их разделения, выделения стабильных нуклидов из разл. объектов и т. д. (см. также, напр., изотопов разделение).
Э. ж. часто сочетают с др. методами, напр. хроматографией, соосаждением, дистилляцией.
Экономич. показатели Э. ж. определяются в осн. стоимостью извлекаемого вещества и экстрагента, а также затратами на его регенерацию. При технико-экономич. анализе процесса необходимо учитывать потери экстрагента, соизмеряя их со стоимостью целевого продукта. Э. ж. — один из самых низкоэнергоемких хим.-технол. процессов и поэтому может успешно конкурировать с иными массообменными процессами. Другие осн. достоинства Э. ж.: низкие рабочие температуры; возможность весьма полного разделения азеотропных смесей и смесей близких по свойствам компонентов; эффективность извлечения ценных и токсичных компонентов из разбавл. растворов; возможность сочетания с иными процессами хим. технологии (напр., ректификацией и кристаллизацией); относит. простота аппаратурного оформления и возможность полной автоматизации.
Лит.: Фомин В. В., Химия экстракционных процессов, М., 1960; Трейбал Р., Жидкостная экстракция, пер. с англ., М., 1966; Золотов Ю. А., Экстракция внутрикомплексных соединений, М., 1968; Последние достижения в области жидкостной экстракции, под ред. К. Хансона, пер. с англ., М., 1974; Справочник по экстракции, под ред. A.M. Розена, т. 1–3, М., 1976–78; БСЭ, 3 изд., т. 30, М., 1978, с. 16–18; Основы жидкостной экстракции, М., 1981; Химический энциклопедический словарь, М., 1983, с. 693–95; Kirk-Othmer encyclopedia of chemical technology, 3 ed., v. 9, N. Y., 1980, p. 672–721; Handbook of solvent extraction, N. Y., 1983.
В. В. Тарасов, А. А. Пичугин
Значения в других словарях
- ЭКСТРАКЦИЯ ЖИДКОСТНАЯ — ЭКСТРАКЦИЯ ЖИДКОСТНАЯ — способ разделения и извлечения компонентов смеси путем их перевода из одной жидкой фазы (напр., водного раствора) в другую (обычно органическую) — содержащую экстрагент. Большой энциклопедический словарь
