электродный потенциал
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение Э. п. обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлич. электродом и раствором электролита пространств. разделение зарядов связано со след. явлениями: переносом ионов из металла в раствор в ходе установления электрохим. равновесия, кулоновской адсорбцией ионов из раствора на поверхность металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллич. решетки, специфич. (некулоновской) адсорбцией ионов или полярных молекул растворителя на электроде и др. Последние два явления приводят к тому, что Э. п. не равен нулю даже при условиях, когда заряд поверхности металла равен нулю (см. потенциал нулевого заряда).
Абс. величину Э. п. отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. Э. п. равен эдс электрохим. цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциал между разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, H2[0,101 МПа] | H+[a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности а ионов H+ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.). При схематич. изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в растворе соли меди равен эдс цепи Pt, H2|HCl CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на фанице HCl и CuCl2 устранен).
CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на фанице HCl и CuCl2 устранен).
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих Э. п., равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение Э. п. наз. стандартным (обозначение E°).
Оно связано со стандартным изменением энергии Гиббса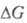 и константой равновесия Кр электрохим. реакции уравнением:
и константой равновесия Кр электрохим. реакции уравнением: 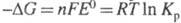 , где F — число Фарадея; п — число электронов, участвующих в реакции; R — газовая постоянная; Т — абс. температура. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах реакции сведены в спец. таблицы (подробнее см. стандартный потенциал).
, где F — число Фарадея; п — число электронов, участвующих в реакции; R — газовая постоянная; Т — абс. температура. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах реакции сведены в спец. таблицы (подробнее см. стандартный потенциал).
Зависимость Э. п. от термодинамич. активностей ai участников электрохим. реакции выражается Нернста уравнением:
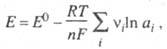
где vi — стехиометрич. коэф. участника реакции, причем для исходных веществ это отрицат. величина, а для продуктов реакции — положительная.
Если через электрод протекает электрич. ток, Э. п. отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод — электролит (см. поляризация).
Лит.: Корыта И., Дворжак И., Богачкова В., Электрохимия, пер. с чеш., М., 1977; Антропов Л. И., Теоретическая электрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии, под ред. Б. Б. Дамаскина, М., 1991.
О. А. Петрий
Значения в других словарях
- Электродный потенциал — Разность электрических потенциалов между Электродом и находящимся с ним в контакте электролитом (См. Электролиты) (чаще всего между металлом и раствором электролита). Возникновение Э. Большая советская энциклопедия
- ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, мера способности электрода вступать в реакцию. Электрод из элемента М, помещенный в раствор его ионов (М+), представляет собой ПОЛУЭЛЕМЕНТ. Научно-технический словарь
