электрохимические цепи
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ
системы из электродов, находящихся в одном и том же электролите либо в контактирующих друг с другом разл. электролитах. Иногда Э. ц. наз. гальванич. цепями. Э. ц. могут быть замкнутыми или разомкнутыми; в частности, Э. ц. наз. правильно разомкнутой, если на концах разомкнутой цепи находятся одинаковые проводники.
Последовательность соединения проводников в Э. ц. изображают схемой: M| раствор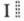 раствор II | М' | М, где М и М' — металлы, сплошные вертикальные черточки указывают границы раздела фаз, а двойная вертикальная пунктирная черта указывает на то, что диффузионный потенциал между растворами I и II отсутствует (элиминирован) (в противном случае используют одинарную пунктирную черту). Отрицат. электрод располагают слева. Разность потенциалов на концах правильно разомкнутой Э. ц. наз. электродвижущей силой цепи (эдс). Э.ц. строго равновесны лишь тогда, когда они не содержат границы двух электролитов и когда эдс цепи скомпенсирована разностью потенциалов от внеш. источника тока.
раствор II | М' | М, где М и М' — металлы, сплошные вертикальные черточки указывают границы раздела фаз, а двойная вертикальная пунктирная черта указывает на то, что диффузионный потенциал между растворами I и II отсутствует (элиминирован) (в противном случае используют одинарную пунктирную черту). Отрицат. электрод располагают слева. Разность потенциалов на концах правильно разомкнутой Э. ц. наз. электродвижущей силой цепи (эдс). Э.ц. строго равновесны лишь тогда, когда они не содержат границы двух электролитов и когда эдс цепи скомпенсирована разностью потенциалов от внеш. источника тока.
Э. ц. обычно различают по наличию или отсутствию в цепи границы двух разл. растворов — соотв. цепи с переносом и цепи без переноса. Т. наз. ф и з. Э. ц. составлены из химически одинаковых электродов, погруженных в один и тот же электролит, но отличаются друг от друга физ. состоянием. Источником электрич. энергии служит различие в физ. состоянии электродов, а при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое. Выделяют аллотропич., гравитационные и термогальванические Э. ц. В аллотропич. Э. ц. электродами служат разл. аллотропич. модификации вещества: в результате протекания тока при замыкании цепи происходит переход менее устойчивой модификации в более устойчивую. В гравитац. Э. ц. два жидких электрода имеют разную высоту, а электродные процессы при замыкании цепи приводят к переносу вещества от электрода с более высоким уровнем к электроду с более низким уровнем и происходит выравнивание уровней. В термогальванич. цепях электрич. энергия возникает за счет переноса тепла от горячего электрода к холодному.
В т. наз. концентрац. Э. ц. электроды совпадают по своим физ. свойствам, хим. составу и природе протекающей на них окислительно-восстановит. реакции, они различаются лишь термодинамич. активностями (концентрациями) окисленных и(или) восстановленных форм вещества. Источник электрич. энергии — свободная энергия переноса вещества от электрода, где активность этого вещества больше. Так, в цепях из двух амальгамных электродов с разл. активностью металла в амальгаме происходит перенос металла из концентрир. амальгамы в разбавленную. В концентрац. Э. ц., составленной из двух одинаковых электродов, погруженных в растворы одинаковых электролитов разл. активности, источником эдс является работа переноса электролита из концентрир. раствора в разбавленный.
В хим. Э. ц. источником электрич. энергии является свободная энергия протекающей реакции. Так, составив Э. ц. М, H2 | KOH водный | O2, M' | M, можно получить электрич. энергию за счет реакции между H2 и O2 с образованием H2O. Указанная цепь составляет основу водородно-кислородных топливных элементов. Важное значение имеет хим. цепь Pt|Cd(Hg)|GdSO4 (насыщенный раствор) |Hg2SO4, Hg|Pt, лежащая в основе стандартного элемента Вестона (см. нормальные элементы). К хим. Э. ц. относятся элемент Даниэля-Якоби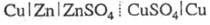 и Лекланше элемент.
и Лекланше элемент.
Большинство хим. Э. ц. — цепи с переносом, в которых растворы (расплавы, твердые электролиты) соединены либо непосредственно, либо через солевой мостик. Комбинируя разл. окислительно-восстановит. полуреакции, можно построить большое число хим. Э. ц. Разность соответствующих стандартных потенциалов позволяет в первом приближении оценить эдс этих цепей. Точное значение эдс на концах цепи с переносом рассчитать не удается из-за невозможности точного определения диффузионного потенциала и из-за того, что в уравнении Нернста термодинамич. активности отд. ионов заменяются ср. активностями или концентрациями этих ионов.
Э. ц. составляют основу химических источников тока. Измерения эдс соответствующим образом подобранных Э. ц. позволяют находить коэф. активности компонентов электролитов, числа переноса ионов, произведения растворимости разл. солей, оксидов, константы равновесия ионных реакций (константы диссоциации слабых кислот и оснований, константы устойчивости растворимых комплексов, в т. ч. ступенчатые константы). Эдс хим. Э. ц. однозначно связана с изменением свободной энергии Гиббса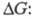 в ходе соответствующей хим. реакции:
в ходе соответствующей хим. реакции: 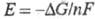 (п — число участвующих в реакции электронов; F — число Фарадея), поэтому измерения эдс могут использоваться для расчета
(п — число участвующих в реакции электронов; F — число Фарадея), поэтому измерения эдс могут использоваться для расчета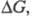 причем часто электрохим. метод определения как относительно простой и высокоточный имеет существенные преимущества перед термохим. методами. Применение уравнения Гиббса — Гельмгольца к Э. ц. при постоянном давлении приводит к соотношению:
причем часто электрохим. метод определения как относительно простой и высокоточный имеет существенные преимущества перед термохим. методами. Применение уравнения Гиббса — Гельмгольца к Э. ц. при постоянном давлении приводит к соотношению:
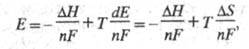
где Т — абс. температура,  и
и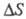 - энтальпия и энтропия реакции. Таким образом, температурные зависимости эдс Э. ц. позволяют найти изменения энтальпии и энтропии электрохим. системы при протекании хим. реакции.
- энтальпия и энтропия реакции. Таким образом, температурные зависимости эдс Э. ц. позволяют найти изменения энтальпии и энтропии электрохим. системы при протекании хим. реакции.
• см. также электрохимическая кинетика
Лит.: Дамаскин Б.Б., Петрий О. А., Электрохимия, М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988.
О. А. Петрий
