электрохимия расплавов
ЭЛЕКТРОХИМИЯ РАСПЛАВОВ
изучает физ.-хим. процессы в расплавл. электролитах. Электролитами служат соли, их смеси и растворы ионизируемых в этих расплавах веществ, напр. оксидов. Температуры плавления используемых электролитов обычно лежат в пределах 400–900 °C. Смеси солей применяют для снижения температуры плавления. Обычно это расплавленные смеси галогенидов щелочных и щел.-зем. металлов (NaCl, KC1, CaCl2, BaCl2 и др.), эквивалентная электрич. проводимость которых составляет 50–150 См * см2. Высокая электрич. проводимость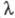 расплавленных солей указывает на ионную природу расплава и служит мерой степени ионизации солей.
расплавленных солей указывает на ионную природу расплава и служит мерой степени ионизации солей.
Особенность расплавленных электролитов, помимо высокой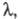 - большое напряжение разложения, часто превышающее 3 В. Это позволяет при электролизе выделять из расплавленных электролитов гораздо больший круг металлов, чем из водных растворов (напряжение разложения воды при комнатной температуре 1,23 В) и создавать хим. источники тока с эдс до 2,5–3,5 В.
- большое напряжение разложения, часто превышающее 3 В. Это позволяет при электролизе выделять из расплавленных электролитов гораздо больший круг металлов, чем из водных растворов (напряжение разложения воды при комнатной температуре 1,23 В) и создавать хим. источники тока с эдс до 2,5–3,5 В.
Процессы на электродах в расплавах электролитов протекают при потенциалах, близких к равновесным по отношению к приэлектродным слоям расплавов. Зависимость потенциала разложения расплава от температуры имеет линейный характер с отрицат. наклоном.
Как и в водных растворах, для металлов в расплавах существуют электрохим. ряды напряжений, индивидуальные для каждого расплавленного электролита. Электродные потенциалы металлов в расплавленных солях подчиняются Нернста уравнению. Разность потенциалов нулевого заряда металлов в расплавленных солях близка к контактной разности потенциалов (возникает между поверхностями двух металлов в вакууме при их соприкосновении) в соответствии с теорией гальванич. потенциалов Фрумкина.
Для расплавов, как и для водных растворов электролитов, характерно образование комплексных соединений. Прочность комплексов увеличивается с увеличением заряда центрального атома, электрохим. потенциала лиганда и радиуса катиона щелочного металла в электролите-растворителе. Для расплавов характерно сосуществование неск. валентных форм ионов, равновесных с металлом. Поэтому средняя валентность ионов металла иногда выражается нецелым числом.
Особенность кинетики электродных процессов в расплавленных солях — высокие скорости электрохим. реакций. Поэтому их можно считать квазиравновесными процессами. Наиб. медленной (лимитирующей) стадией электродного процесса обычно является массоперенос вещества к электроду (диффузия или миграция). Исключением являются стадии зарождения кристаллов при электрокристаллизации и образование молекул газа из адсорбированных на электроде атомов, которые протекают еще медленнее (или с соизмеримыми скоростями). Например, разряд А1 в расплавленных хлоралюминатах, как показано с помощью импедансных измерений, происходит в условиях одновременного замедленного протекания разряда, кристаллизации и диффузии.
Высокая температура ускоряет в значит. степени диффузию в твердой фазе, что обусловливает образование диффузионных сплавов при осаждении металла на твердом электроде.
Полярографич. методы позволяют определить в ионных расплавах для многих электродных процессов коэф. диффузии, энергию активации, толщину диффузионного слоя, коэф. переноса, константы скорости реакций, токи обмена.
Электролизом расплавленных солей получают А1, а также Mg, щелочные металлы, Ca, Zr, Th и др., рафинируют Ti, металлы платиновой группы. Разработаны методы получения покрытий из металлов, сплавов и интерметаллидов электроосаждением и бестоковым методом — переносом через солевой расплав благодаря энергии, выделяющейся при образовании сплавов, контактным восстановлением и диспропорцио-нированием, стимулированным комплексообразованием.
Покрытия, полученные из расплавленных солей, обладают высокой чистотой, пластичностью, хорошим сцеплением с основой, исключают наводороживание покрываемого изделия, что обеспечивает более высокие технол. качества, чем при получении покрытий из водных растворов. Гальванопластикой из расплавленных солей получают фасонные полые изделия из тугоплавких металлов (Ni, Mo, Re) и металлов платиновой группы (Ir, Ru).
На основе расплавленных солей созданы высокотемпературные хим. источники тока, обладающие высокими эдс и большими разрядными токами. Высокотемпературные топливные элементы с расплавленным карбонатным электролитом преобразуют при 650–700 °C хим. энергию газообразного топлива (водород, природный газ) в электроэнергию с кпд прямого преобразования до 60%. Перспективно их использование в стационарной энергетике.
Лит.: Укше Е. А., Букун Н. Г., в кн.: Итоги науки и техники. Растворы. Расплавы, т. 2, М., 1975, с. 140–71; Барабошкин А. Н., Электрокристаллизация металлов из расплавленных солей, М„ 1976; Электрохимия расплавленных солей и металлов, под ред. К. П. Селезнева, Л., 1976; Делимарский Ю. К., Электрохимия ионных расплавов, М., 1978.
Г. В. Жутаева
