электрокатализ
ЭЛЕКТРОКАТАЛИЗ
изменение скорости или направления электрохим. процесса в зависимости от материала электрода или модификации его поверхности. Термин "Э." относят к процессам, общие стехиометрич. уравнения которых не включают материал электрода, напр. выделение водорода, кислорода, хлора, электроокисление или электровосстановление орг. соединений и т. п. Электрохим. реакции типа анодного растворения меди (Cu Cu2+ + 2е) или катодного восстановления анионов
Cu2+ + 2е) или катодного восстановления анионов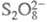 до
до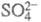 к электрокаталитическим не относятся.
к электрокаталитическим не относятся.
Как правило, электрокаталитическими являются многостадийные процессы, в которых одной из обязат. стадий является адсорбция на электроде тех или иных компонентов электродной реакции (исходных, промежуточных или конечных). Это связано с тем, что с учетом структуры двойного электрического слоя скорость реакции, не сопровождающейся адсорбцией, оказывается практически не зависящей от материала электрода. Некоторые ученые относят к Э. лишь процессы, в которых имеет место хемосорбция к.-л. компонентов реакции.
Типичным злектрокаталитич. процессом является электроокисление орг. соед. на металлах платиновой группы, которое, как правило, сопровождается деструкцией исходных молекул, их дегидрированием (или их фрагментов), прочной хемосорбцией промежут. частиц, причем некоторые из этих частиц м. б. каталитич. ядами по отношению к токоопределяющему маршруту анодного процесса. Так, электрокаталитич. окисление предельных углеводородов (C1-C6) на Pt-электроде до CO2 обусловлено наличием сложной цепочки промежут. стадий, включающей разрыв связей С — С, С — Н, хемосорбцию фрагментов исходных молекул на поверхности металла-катализатора, участие в отд. стадиях адсорбир. молекул H2Oадс или частиц OHадс и т. п. Граница между "чисто электрохимич." и электрокаталитич. реакциями является весьма условной.
Осн. отличие электрокаталитич. реакций от гетерогенно-каталитических — зависимость скорости процесса от потенциала электрода Е. Кинетич. уравнение электрокаталитич. реакции выражает аналит. связь между током I через электрохим. ячейку и потенциалом Е, объемной концентрацией сi исходных реагирующих веществ, поверхностными концентрациями (заполнениями поверхности) частиц, участвующих в токоопределяющем маршруте (или маршрутах) процесса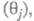 и других адсорбир. или хемосорбир. частиц, таких, как ионы раствора, продукты превращения исходных реагентов и молекул растворителя и т. п.
и других адсорбир. или хемосорбир. частиц, таких, как ионы раствора, продукты превращения исходных реагентов и молекул растворителя и т. п.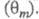 В общем виде это выражение можно записать след. образом:
В общем виде это выражение можно записать след. образом:
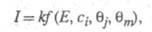
где k — постоянная. Меняя Е, можно на неск. порядков изменить скорость целевой реакции; при этом значение Е влияет как на энергию активации реакции, так и (в осн.) на поверхностные концентрации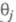 и
и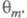 Во мн. случаях с изменением Е меняются не только
Во мн. случаях с изменением Е меняются не только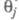 и
и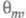 но и природа частиц j и т, что приводит к изменению направления электродного процесса. В Э., как и в жидкофазном катализе, важную роль играет адсорбция растворителя, однако спецификой Э. является возможность участия в разл. стадиях процесса частиц, образующихся в результате электрохим. реакций с участием растворителя (напр., в водных растворах — частиц Hадс и OHадс). Другая особенность Э. — адсорбция на поверхности ионов фонового электролита и ее влияние на электродные реакции.
но и природа частиц j и т, что приводит к изменению направления электродного процесса. В Э., как и в жидкофазном катализе, важную роль играет адсорбция растворителя, однако спецификой Э. является возможность участия в разл. стадиях процесса частиц, образующихся в результате электрохим. реакций с участием растворителя (напр., в водных растворах — частиц Hадс и OHадс). Другая особенность Э. — адсорбция на поверхности ионов фонового электролита и ее влияние на электродные реакции.
Строгой теории, связывающей физ. и хим. свойства металла с его электрокаталитич. активностью, не существует даже для относительно простых и ярко выраженных случаев Э. Это относится и к наиб. изученной реакции — ионизации-разряда водорода, ток обмена которой в зависимости от природы электрода меняется более чем на 10 порядков (наименее активны Hg, Cd, Pb, наиб. активны Pt, Rh, Ir). Представления о механизме Э. пока носят феноменологич. характер. Влияние на скорость реакции материала электрода связывается прежде всего с изменением энергии адсорбции и степени заполнения поверхности частицами j и т. К наиб. активным электродным материалам относятся металлы группы Pt и Ni, что, по-видимому, в первую очередь обусловлено их высокой адсорбционной (хемосорбционной) способностью. В этом отношении Э. аналогичен гетерогенному катализу.
Из неметаллич. электрокатализаторов неорг. природы (оксидов, карбидов, сульфидов и др.) наиб. изучены оксидные системы и углеродные материалы. Устойчивость оксидов при высоких анодных потенциалах объясняет их преим. использование в реакциях электроокисления и электросинтеза (типичный пример — применение оксидных рутениево-титановых анодов ОРТА в процессе выделения хлора). Большое число функц. групп на поверхности углеродных материалов позволяет осуществлять на них широкий круг электрокаталит. процессов с достаточно высокой селективностью.
Активность смешанных электрокатализаторов, состоящих из неск. компонентов, часто оказывается выше активности отд. составляющих. Например, скорость электроокисления метанола на сплаве Pt-Ru повышается на 3 порядка по сравнению со скоростью процесса на Pt. Выяснение причин повышения активности при переходе к смешанным катализаторам включает прежде всего установление корреляций между объемными и поверхностными свойствами электрода, поскольку даже элементный состав поверхностного слоя нередко может существенно отличаться от объемного состава.
В Э. широко используют модифицирование поверхности домонослойными, моно- или полислойными покрытиями. Адатомы, образующиеся в результате адсорбции ионов с практически полным переносом заряда (напр., Sn2+ + 2e Snадс), также нередко активируют поверхность. Модифицирование поверхности разл. непроводящими орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать системы со специфич. адсорбционными и каталитич. свойствами, обусловленными в первую очередь функциональными группами модификатора. Для таких систем часто используют назв. "химически модифицированные электроды". Ускорение электрохим. реакций в присутствии биол. катализаторов — ферментов — часто наз. биоэлектрокатализом.
Snадс), также нередко активируют поверхность. Модифицирование поверхности разл. непроводящими орг. соед., включая металлоорг. комплексы и полимеры, позволяет создавать системы со специфич. адсорбционными и каталитич. свойствами, обусловленными в первую очередь функциональными группами модификатора. Для таких систем часто используют назв. "химически модифицированные электроды". Ускорение электрохим. реакций в присутствии биол. катализаторов — ферментов — часто наз. биоэлектрокатализом.
Впервые термин "Э." был использован Н. И. Кобозевым и В. В. Монблановой в 1934. Как самостоят. научное направление Э. сформировался в 60-х гг. 20 в. в связи с проблемой создания топливных элементов. Широкое развитие работ по Э. вызвано прежде всего запросами практики. Активные и селективные электрокатализаторы необходимы для создания высокоэкономичных процессов электролиза (в производствах водорода, кислорода, хлора и т. д.) и электрохим. генераторов (водород-кислородных, на орг. топливе и др.), для проведения и интенсификации электросинтеза орг. и неорг. соед., разработки разнообразных датчиков (в т. ч. мед. назначения), решения проблем экологии.
Лит.: Проблемы электрокатализа, под ред. B.C. Багоцкого, М, 1980; Электродные процессы в растворах органических соединений, под ред. Б. Б. Дамаскина, М., 1985; Appleby A. J., в кн.: Comprehensive treatise of electrochemistry, v. 7, N. Y. — L., 1983, p. 173–239.
Б. И. Подловченко
Значения в других словарях
- Электрокатализ — Изменение скорости и селективности электрохимических реакций, достигаемое в результате каталитического действия электродов, на поверхности которых эти реакции протекают. Явление Э. впервые было обнаружено в начале... Большая советская энциклопедия
- электрокатализ — орф. электрокатализ, -а Орфографический словарь Лопатина
