элиминирования реакции
ЭЛИМИНИРОВАНИЯ РЕАКЦИИ (реакции отщепления)
отщепление от молекулы орг. соед. частиц (атомов или атомных групп) без замены их другими. Различают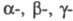 и d-Э. р. При α-элиминировании (отщепление частиц от одного атома) образуются валентно-ненасыщ. соед. (напр., карбены, нитрены), при β-элиминировании (отщепление частиц от соседних атомов) — соед. с кратными связями (С = С, С = С, С = N, C = N), при
и d-Э. р. При α-элиминировании (отщепление частиц от одного атома) образуются валентно-ненасыщ. соед. (напр., карбены, нитрены), при β-элиминировании (отщепление частиц от соседних атомов) — соед. с кратными связями (С = С, С = С, С = N, C = N), при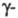 либо
либо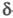 -элиминировании (отщепление частиц от атомов, разделенных одним или двумя атомами) — циклич. соед. Разновидность Э. р. — выброс фрагмента из углеродной цепи или цикла с образованием новой
-элиминировании (отщепление частиц от атомов, разделенных одним или двумя атомами) — циклич. соед. Разновидность Э. р. — выброс фрагмента из углеродной цепи или цикла с образованием новой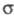 -связи (такие реакции иногда наз. реакциями экструзии).
-связи (такие реакции иногда наз. реакциями экструзии).
Наиб. изучены реакции β-элиминирования. Для них возможны 3 механизма — Е2, Е1 и Е1сВ (обозначение Е от англ. elimination). В реакциях бимол. элиминирования (механизм Е2) две группы отщепляются одновременно в одну стадию, при этом протон связывается с катализатором-основанием В:
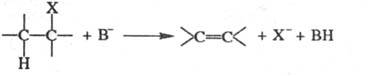
Реакция стереоспецифична. Если группы Н и X находятся в антиперипланарном положении (см. номенклатура стереохимическая), то при Э. они уходят в противоположном направлении; происходит т. наз. анти-Э. Если же группы Н и X находятся в синперипланарном положении, то при Э. они уходят в одном направлении (син-Э.). анти-Э. обычно предпочтительнее, чем син-Э. Известно много примеров обоих видов Э. Так, при элиминировании HBr из мезо-1,2-дибром-1,2-дифенилэтана образуется цис-2-бромстильбен, тогда как из рацемата получается транс-олефин. анти-Элиминирование эритро-соед. приводит к цис-олефинам, а трео-соед. — к транс-изомерам.
В некоторых случаях, когда возможно образование ионных пар, а также под влиянием стерич., конформац. и других факторов происходит (а иногда даже преобладает) син-элиминирование. Наиб. склонность к этим реакциям проявляют соед. с группой N(CH3)3.
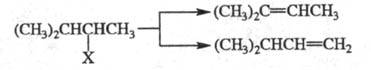
β -Элиминирование галогеноводородов из алкилгалогенидов либо воды из спиртов подчиняются в основном Зайцева правилу (атом Н отщепляется от наименее гидрогенизир. атома углерода), а Э. р. при термич. разложении четвертичных аммониевых оснований — правилу Гофмана (из неск. возможных олефинов образуется тот, который содержит наименьшее число алкильных заместителей, обычно этилен; см. Гофмана реакции), напр.:
Мономол. механизм E1 — двухстадийный процесс, в котором медленная лимитирующая стадия — ионизация субстрата с образованием карбкатиона; последний быстро отдает протон основанию, которым часто служит растворитель:
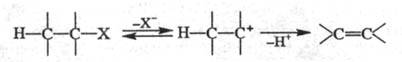
Обычно реакции по механизму E1 идут без добавления основания, они нестереоспецифичны, т. к. прежде чем отдать протон, карбкатион может принять наиб. устойчивую конформацию.
По карбанионному механизму E1cB сначала отщепляется Н, а затем Х. Это двухстадийный процесс, в котором интермедиатом служит карбанион:
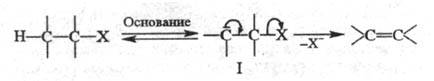
Обозначение механизма символом E1cB отражает участие в реакции сопряженного основания формулы I (сВ — сопряженное основание, conjugated base). По механизму E1cB преим. реагируют субстраты, у которых водород активирован сильными электроноакцепторными группами.
Э. р., протекающие в газовой фазе (пиролитич. элиминирование), могут происходить по перициклич. и свободнорадикальному механизмам.
О механизме фотохим. Э. р. карбонильных соед. см. фрагментации реакции.
Э. р. применяют в орг. синтезе для получения олефинов (см., напр., Бэмфорда — Стивенса реакция), а также циклич. соед., напр., образование β-лактамов из эфиров β-аминокислот под действием реактива Гриньяра (реакция Брекпота):
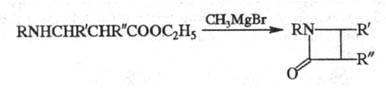
К Э. р. с образованием σ-связи относится, напр., превращение дибензилнитрозоамина в дибензил при действии дитионита натрия (реакция Овербергера — Ломбардино):
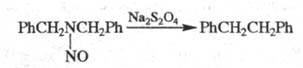
• см. также дегидратация, дегидрогалогенирование, хелетропные реакции
Лит.: Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 673–81; Mapч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 5–108.
