Этара реакция
ЭТАРА РЕАКЦИЯ
окисление метильной группы в ароматич. соед. в альдегидную под действием хромилхлорида (иногда к Э. р. относят любые реакции в орг. химии с участием CrO2Cl2):
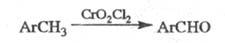
Ароматич. ядро может содержать заместитель: Hal, NO2, Alk и AlkO (хотя две последние группы также могут окисляться в ходе реакции). Вместо CrO2Cl2 можно использовать CrO2(OCOR)2 (R= CH3, C6H5, CCl3), что способствует увеличению выхода.
Обычно хромилхлорид смешивают с ароматич. соед. в среде инертного орг. растворителя (CS2, CCl4, CHCl3, C6H5С1 и др.) при 10–50 °C. Образовавшийся комплекс состава ArCH3 x 2CrO2Cl2 (часто выпадает в осадок) обрабатывают H2O. Выходы составляют 50–70%. Основные побочные продукты — хлорированные ароматич. соед. и продукты более глубокого окисления.
Механизм Э. р. известен лишь в общих чертах. Установлено, что стадия, определяющая скорость реакции,- расщепление связи С — Н в метильной группе при образовании аддукта с первой молекулой CrO2Cl2. Полагают, что этот процесс может идти по ионному либо радикальному механизму, давая в обоих случаях на первой стадии аддукт типа ArCH2—О —Cr(OH)Cl2, который быстро присоединяет вторую молекулу хромилхлорида. Образующееся соед. имеет, по-видимому, структуру ArСН[ОCr(OH)Cl2]2.
В условиях Э. р. метилзамещенные алициклич. соед. в присутствии каталитич. количеств олефинов (ок. 1%) дают соответствующие альдегиды с выходом 25%.
При действии CrO2(OR)2 и циклич. олефины образуются линейные диальдегиды:
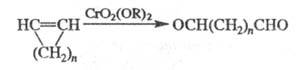
Э. р. используют в препаративной практике. Реакция открыта А. Этаром в 1877.
Лит.: Грагеров И.П., Пономарчук М.П., "Ж. орган. химии", 1967, т. 3, № 3, с. 458–64; 1969, т. 5, № 6, с. 1145–47; Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 295–96; Наг ford W., "Chem. Вег.", 1958, Bd 58, S. 25; Nenitzescu C, "Bull. Soc. chim. France", 1968, p. 1349.
Г. И. Дрозд
