этиламины
ЭТИЛАМИНЫ C2H5NRR'
В статье рассмотрены первичный, вторичный и третичный амины, содержащие только этильные остатки (см. табл.). Первичный Э. (моноэтиламин, R = R' = Н) — бесцветный газ, вторичный (диэтиламин, R = C2H5, R' = Н) и третичный (триэтиламин, R = R' = C2H5) — бесцв. маловязкие жидкости со специфич. аминным запахом. Неограниченно смешиваются с водой, хорошо раств. в этаноле и др. органических растворителях. Триэтиламин образует азеотропную смесь с этанолом (51% по объему триэтиламина, т. кип. 76,9 °C).
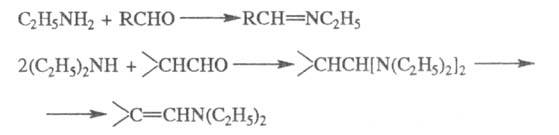
Э. — сильные основания, обладают свойствами аминов. С минер. и орг. кислотами образуют кристаллич. соли. При взаимодействии с карбоновыми кислотами (при повышенных температурах), их ангидридами, хлорангидридами и эфирами моно- и диэтиламины превращаются соотв. в N-этил- и N,N-диэтиламиды кислот. Реакция с альдегидами и кетонами приводит к шиффовым основаниям и енаминам; последние при гидрировании дают N-этил- и N,N-диэтилалкиламины, напр.:
При реакции диэтиламина с формальдегидом получают N,N,N' ,N' — тетраэтилметилендиамин:
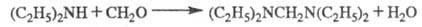
Моноэтиламин алкилируется спиртами и алкилгалогенидами до вторичных и третичных алкиламинов; диэтиламин — до N,N-диэтилалкиламинов; триэтиламин — до четвертичных аммониевых солей (из алкилгатогенидов). Моно- и диэтиламины реагируют с CO2 и CS2, превращаясь в соли соотв. карбаминовых [(C2H5NHCOOH x H2NC2H5] и дитиокарбаминовых кислот [(C2H5)2NCSSH x HN(C2H5)2]; при обработке этиленоксидом образуются соотв. N-этилэтаноламин и N,N-диэтилэтаноламин или их полиоксиэтильные производные; при обработке фосгеном — этилизоцианат и тетраэтилмочевина.
СВОЙСТВА ЭТЕЛАМИНОВ
таблица в процессе добавления
* При 16 °C. ** В воздухе рабочей зоны.
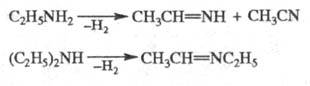
При взаимодействии с лактамами моноэтиламин дает N-этиллактамы, с хлороформом в присутствии щелочи — этилизонитрил, с HNO2 — этанол и N2 (количественно). Э. диспропорциониру-ют при повышенных температурах над катализаторами дегидратации или гидрирования (в присут. H2); при этом из моноэтиламина получаются диэтиламин и аммиак, из диэтиламина — моноэтиламин и триэтиламин. В присут. катализаторов гидрирования при высоких температурах моноэтиламин и диэтиламин дегидрируются:
В промышленности смесь Э. получают парофазным аминированием этанола в присутствии Al2O3, SiO2 или их смеси при 350–450 °C, давлении 2–20 МПа, молярном соотношении NH3 → C2H5OH (2:6) либо в присуг. Ni, Co, Cu, Re и др. и H2 при 150–230 °C, давлении 1,7–3,5 МПа, молярном соотношении C2H5OH:NH3:H2 l:(l,5-6):(2–5). Выход в первом случае 75–80%, во втором — 90–95% при конверсии этанола 95–100%. Состав смеси Э. регулируют количеством NH3, температурой процесса и направлением в рецикл одного или двух Э. Образующуюся смесь Э., H2O, NH3 и непрореагировавшего этанола разделяют ректификацией под давлением 0,1–1,8 МПа, получая моно-, ди- и триэтиламины.
В лаборатории Э. синтезируют методами, общими для получения алифатич. аминов, в т. ч. гидрированием ацетонитрила или нитроэтана, восстановит. аминированием ацетальдегида, аммонолизом диэтилового эфира или этилгалогенидов.
Моноэтиламин без примесей ди- и триэтиламина синтезируют по реакциям Габриеля и Гофмана.
Анализируют Э. методами ГЖХ и титрованием кислотами растворов Э. в воде или в органических растворителях. В воздухе Э. определяют методом ГЖХ или колориметрически.
Э. применяют в производстве пестицидов (напр., симазин, атразин, цианазин и др.), ингибиторов коррозии (напр., N,N-диэтилмочевина, динитробензоат диэтиламина и др.), лек. веществ (напр., новокаин, кардиамин и др.), катализаторов синтеза полиуретанов.
Моноэтиламин используют также для получения пластификаторов, флотореагентов, текстильно-вспомогат. веществ, антиобледенит. композиций, ускорителей вулканизации каучука; диэтиламин — для получения присадок к моторным топливам и маслам, отвердителей эпоксидных смол; триэтиламин — для производства жидких ракетных топлив, антисептиков для древесины, олигомеров, стабилизаторов трихлорэтилена.
Э. в больших концентрациях оказывают вредное влияние на печень, почки, нервную систему; раздражают кожу, слизистые оболочки глаз, верхних дыхат. путей.
Лит.: Бобков С. С, Смирнов С. К., Синильная кислота, М., 1970, с. 141; Справочник нефтсхимика, т. 2, Л., 1978, с. 293–94; Паушкин Я. М., Жидкие и твердые химические ракетные топлива, М., 1978, с. 127; Kirk-Othmer encyclopedia, 3 ed., v. 2, N. Y., 1978, p. 272–82.
М. И. Якушкин
