этиленоксид
ЭТИЛЕНОКСИД (оксиран, 1,2-эпоксиэтан, окись этилена)
мол. м. 44,05; бесцветный газ или жидкость с характерным эфирным запахом; т. пл. −112,5 °C, т. кип. 10,7 °C; 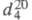 0,8697;
0,8697; 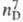 1,3597; длины связей 0,1462 нм (С —С), 0,1086 нм (С —Н), 0,1428 нм (C—O), углы НСН 116,9°, СОС 61,62°; tкрит 195,8 °C, pкрит 7,19 МПа; Давление пара 145,8 кПа (20 °C);
1,3597; длины связей 0,1462 нм (С —С), 0,1086 нм (С —Н), 0,1428 нм (C—O), углы НСН 116,9°, СОС 61,62°; tкрит 195,8 °C, pкрит 7,19 МПа; Давление пара 145,8 кПа (20 °C); 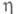 0,26 мПа∙с (20 °C); γ 24,3 мН/м (20 °C);
0,26 мПа∙с (20 °C); γ 24,3 мН/м (20 °C); 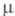 6,34∙10−30Кл∙м;
6,34∙10−30Кл∙м; 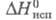 25,82 кДж/моль;
25,82 кДж/моль; 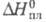 5,17 кДж/моль;
5,17 кДж/моль; 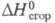 -1306 кДж/моль (газ); хорошо раств. в воде, этаноле, углеводородах и др. органических растворителях.
-1306 кДж/моль (газ); хорошо раств. в воде, этаноле, углеводородах и др. органических растворителях.

При нагр. до 300 °C Э. устойчив, св. 400 °C в смеси с N2 изомеризуется в ацетальдегид или образует этилен (при избытке Э.); при окислении O2 в водном растворе AgNO3 образуется гликолевая кислота, при окислении на оксидных и Ag-кат. — CO2 и H2O; при гидрировании над Ni-кат. при 30 °C — этанол.
Для Э. характерны реакции, сопровождающиеся размыканием цикла, что используют для оксиэтилирования (введение группы CH2CH2OH в орг. соед.). Большинство реакций с нуклеоф. реагентами протекают через промежут. образование оксониевого комплекса. Гидратация Э. при 130–150 °C и давлении 1,5–2 МПа в присутствии кислотных или основных катализаторов приводит к этиленгликолю:
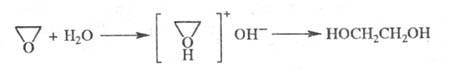
При взаимодействии Э. с галогеноводородами в водной среде образуются галогенгидрины; наиб. легко реагируют HBr и HI, труднее — HCl; реакцию с HF проводят в среде диэтилового эфира (безводный HF вызывает цепную полимеризацию Э.).
Со спиртами при нагревании Э. дает целлозольвы, а при избытке Э. — карбитолы или эфиры полигликолей. С NH3 в присутствии небольшого количества воды образуется смесь моно-, ди-или триэтаноламинов; реакция диалкилэтаноламинов с Э. приводит к аминопроизводным полиэтиленгликолей:
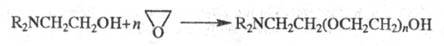
Э. легко реагирует с HCN в присутствии щелочей, образуя этиленциангидрин, при дегидратации которого получают акрилонитрил.
С H2S в присутствии воды при нагр. Э. дает тиогликоль HSCH2CH2OH и тиодигликоль S(CH2CH2OH)2; в присутствии Al2O3 при 200 °C — 1,4-дитиан или 1,4-оксатиан, с тиолами образуются соответствующие орг. сульфиды.
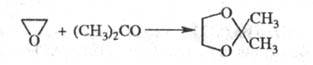
Реакции Э. с орг. кислотами или их ангидридами приводят к моно- и диэфирам этиленгликоля; с альдегидами и кетонами в присутствии SnCl2 или BF3 — к циклич. ацетатам или кеталям, напр.:
Э. вступает в реакцию Фриделя — Крафтса с ароматическими углеводородами; эта реакция лежит в основе синтеза β-фенилэтилового спирта, последний образуется также при взаимодействии Э. с фенилмагнийхлоридом.
Реакция Э. с CO2 в присутствии четвертичных солей аммония, фосфония и третичных аминов при 150–200 °C и давлении 2–8 МПа приводит к этиленкарбонату.
Э. легко полимеризуется, в зависимости от природы инициатора можно получать полиэтиленоксид разл. мол. массы. Известны также блоксополимеры Э., напр. с пропиленоксидом (см. проксанолы), с пропиленоксидом и этилендиамином (см. проксамины). При димеризации Э. образуется 1,4-диоксан.
Осн. пром. метод синтеза Э. — окисление этилена. Процесс осуществляют в трубчатых реакторах на неподвижном слое катализатора (серебро с промотирующими или модифицирующими добавками, нанесенное в количестве 10–15% по массе на пористый корундовый носитель) при 200–300 °C и давлении 1–3 МПа, окислителями могут служить воздух или кислород.
Э. может быть получен также дегидрохлорированием этиленхлоргидрина (этот метод ранее использовался в промышленности), действием щелочи на β-хлорэтилацетат ClCH2CH2OCOCH3 при 100 °C либо на этилгипохлорит C2H5OCl, окислением этилена орг. надкислотами (реакция Прилежаева).
Э. — важный продукт основного орг. синтеза. Его применяют в производстве этиленгликолей, галогенгидринов, этаноламинов, диоксана, фенилэтанола, полиэтиленгликолей, неионогенных ПАВ, а также в медицине для стерилизации мед. инструментов, одноразовых шприцов.
Э. — горюч, взрывоопасен и токсичен; КПВ 3–100% (по объему); т. всп. < −18 °C; при 22-кратном разбавлении становится негорючим. Оказывает общеядовитое действие, раздражает кожу и слизистые оболочки. ПДК в воздухе рабочей зоны 1 мг/м3.
Мировое производство ок. 9 млн. т в год (1989).
Лит.: Окись этилена, М, 1967; Kirk-Othmer encyclopedia, 3 ed., v. 9, N. Y., 1980, p. 432–71.
Б. Б. Чесноков
Значения в других словарях
- этиленоксид — орф. этиленоксид, -а Орфографический словарь Лопатина
- ЭТИЛЕНОКСИД — ЭТИЛЕНОКСИД (оксиран) — бесцветный газ — tкип 10,7 °С. Сырье для получения ацетальдегида, акрилонитрила, этиленгликоля, этаноламинов, целлозольвов, красителей и др. Дезинфицирующее средство. Большой энциклопедический словарь
